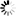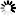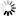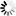摘要:北卡罗来纳大学医学院生物化学和生物物理系的Susanna Stroik博士和Dale Ramsden博士对一种在遗传性乳腺癌、卵巢癌和前列腺癌患者中过度表达的酶有了更多的了解。
我们的DNA不是坚不可摧的。在我们的一生中,DNA会因自然和环境因素而断裂。值得庆幸的是,我们的身体有专门的酶和途径,可以通过几种不同的机制将破碎的DNA粘合在一起,这些机制被称为DNA修复途径。
然而,一些癌症可以劫持这些途径为自己的利益。Susanna Stroik博士和Dale Ramsden博士都是北卡罗来纳大学医学院和北卡罗来纳大学Lineberger综合癌症中心生物化学和生物物理系的研究人员,他们拼凑出了一条鲜为人知的DNA修复途径,称为聚合酶θ介导的末端连接(TMEJ)。
在《自然》(Nature)杂志发表的一篇文章中,研究人员一步一步地阐述了这一途径,这一途径在许多遗传性乳腺癌、卵巢癌和前列腺癌患者中,特别是在那些涉及 BRCA1 和 BRCA2 突变的患者中,被发现上调,而新的知识可能会带来新的癌症疗法。
 图1 聚合酶δ和θ在θ介导的末端连接的逐步需求
图1 聚合酶δ和θ在θ介导的末端连接的逐步需求Ramsden实验室的博士后研究员Stroik说:“患有这些乳腺癌突变的人,他们的癌症依赖于聚合酶的修复途径来保持肿瘤存活并修复癌组织中的DNA损伤。现在我们对这一途径有了更多的了解,从理论上讲,科学家们可以生产出一种药物,可以破坏癌细胞中这一途径的关键部分,而不是使用传统的化疗方法,在破坏癌症的同时破坏健康细胞。”
聚合酶θ的发现
在所有DNA修复途径中,TMEJ是最难以捉摸的。Richard Wood博士是德克萨斯大学MD安德森癌症中心的杰出教授,他在2003年首次鉴定聚合酶theta中发挥了关键作用。
在接下来的15年里,包括Wood、Ramsden和Gupta实验室(也在Lineberger综合癌症中心)在内的多个实验室都能够将聚合酶与DNA修复(TMEJ)和癌症联系起来。Sylvie doubli博士是北卡罗来纳大学教堂山分校的校友,也是佛蒙特大学微生物学和分子遗传学教授,她随后解开了聚合酶θ的第一个结构。
这些研究人员与来自宾夕法尼亚州立大学和纽约大学的其他科学家一起,致力于准确地了解TMEJ中涉及的步骤,以及这些步骤中聚合酶θ起作用和不起作用的步骤。
在这些合作者的帮助下,Stroik能够使用各种尖端的实验方法来填补我们对TMEJ通路的理解空白。至至关重要的是,她发现另一种叫做聚合酶δ的聚合酶,与聚合酶θ一起使用一个伙伴系统来协助它完成这一修复途径。
独特的伙伴系统
Stroik的研究表明,聚合酶θ在某些方面表现出色,但在另一些方面却不尽人意。
“它会产生很多错误,而且不能一次产生大量的DNA,”Stroik说。“整个发现的精妙之处在于,有两种不同的酶在途径步骤之间交替,相互帮助。”
 图2 TMEJ的基本机制和验证
图2 TMEJ的基本机制和验证当双链断裂发生时,两条DNA链在同一点被剪断,就像剪刀剪断头发一样。聚合酶反应迅速,抓住两条DNA单链,将最接近断裂的碱基对配对,并将它们固定在一起。
然而,这通常会在末端留下一些单链DNA的残余褶叶。聚合酶δ跳进去切断多余的褶叶,给聚合酶θ足够的空间开始合成新的DNA来填补DNA链上的空白。最后,聚合酶δ最后一次加入来帮助聚合酶θ完成合成。
Stroik还有另一个突破性的发现:聚合酶δ与聚合酶θ在物理上是相互连接的。这一新信息可能对希望通过药物这种相互作用来创造一种新的癌症治疗方法的药物开发人员特别有用。
癌症治疗潜力
由于许多癌症利用TMEJ通路来维持肿瘤存活,许多研究人员已经在研究制造可以干扰该通路的药物,从根本上阻止癌症自我修复,导致其最终死亡。
Ramsden说:“任何时候你发现新的通路,你都可以‘给它下药’。”
Stroik和Ramsden的新研究将为聚合酶θ和δ的基础研究做出贡献,同时也有助于目前处于临床试验中的称为聚合酶θ抑制剂的新型抗癌药物。
参考资料
[1] Stepwise requirements for polymerases δ and θ in theta-mediated end joining