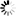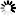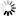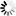季胺标记葡聚糖
化学名称: 2-hydroxypropyl-trimethylammonium-dextran chloride
季胺标记葡聚糖是葡聚糖的多聚阳离子衍生物。由于该衍生物只含季胺基,不同于DEAE标记葡聚糖,季胺标记葡聚糖的带电范围很广(pH 4-10)。季胺标记葡聚糖的净电荷也比相应的DEAE标记葡聚糖强得多。TdB提供分子量从4kDa到150kDa的季胺标记葡聚糖。季胺标记葡聚糖为白色粉末。
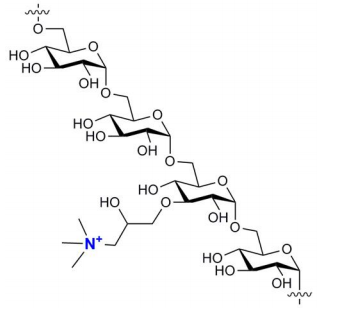 图1 季胺标记葡聚糖结构。季胺标记葡聚糖只含季胺基。该衍生物极易溶于水和电解质溶液,呈白色粉末。
图1 季胺标记葡聚糖结构。季胺标记葡聚糖只含季胺基。该衍生物极易溶于水和电解质溶液,呈白色粉末。合成与结构
季胺标记葡聚糖是由葡聚糖与2,3-环氧丙基三甲基氯化铵反应合成1–3。纯化后,检测控制产品的平均分子量(Mw,Mn)、溶解度、取代度和干燥失重等指标。可根据客户要求定制。
用葡聚糖的平均分子量来表征产品,例如,季胺标记葡聚糖70具有约70 000的重均分子量(Mw)。产品实际分子量使用凝胶渗透色谱法(GPC)测定,并在分析证书中注明。葡聚糖和终产物的Mw差异取决于取代后分子流体动力学体积的变化。葡聚糖部分的重量平均分子量(Mw)为4000到2000000,并且经GPC、吸光度、氮含量、pH、比旋光度和干燥失重等指标的严格控制。
葡聚糖来源于明串珠菌肠系膜B-512F,本质上是一个线性的α-(1-6)-连接的葡萄糖链,但是沿链分布的α-(1-3)分支的百分比很低(2-5%)4。
物理性质
季胺标记葡聚糖极易溶于水和电解质溶液,呈白色粉末。季胺标记葡聚糖只含季胺基(见图1)。与DEAE标记葡聚糖不同,季胺标记葡聚糖在葡聚糖的正常使用范围内(ph4-10)带正电荷。氮含量约为2%(通过元素分析),相当于每四个葡萄糖单元中大约有一个季铵基。从分子量测定(GPC)可以推断季胺标记葡聚糖流体动力学体积与葡聚糖本身没有太大差别。这些产物的净电荷比对应的DEAE标记葡聚糖强得多,因此在电效应相对重要的体系中,响应会得到增强5,6。由于季胺取代基的存在,该产品具有显著的阳离子特性,并且将表现出与聚阴离子表面或分子的亲和力5,6。
季胺标记葡聚糖不溶于大多数有机溶剂,例如乙醇、甲醇、丙酮、氯仿、乙酸乙酯和乙醚。阳离子聚合物的溶液性质已经得到广泛的研究,主要是通过粘度计测定,文末列出了一些例子5,6。
储存和稳定性
虽然没有正式的有关季胺取代葡聚糖稳定性研究见诸报道,但DEAE取代葡聚糖的相关研究有许多文献可供参考。由于该物质与季胺标记葡聚糖相似,我们可以推测在室温下储存其质量和功效可维持三年以上。建议将产品储存在密封容器中,避光保存。在室温下季胺标记葡聚糖储存于密封良好的干燥容器中,可稳定6年以上。
应用
聚阳离子产物在细胞体系中具有广泛的作用,也可以作为疫苗佐剂。
在生物系统中,聚阳离子多糖可引发许多有趣的效应,这可能是由其阳离子性质以及与一般带有负电荷的组织和细胞表面的相互作用导致。季胺标记葡聚糖的净电荷比相应的DEAE标记葡聚糖强得多,因此,在电荷效应显得重要的系统中,季胺标记葡聚糖可给出更强的响应。
随机选择了一些聚阳离子多糖在许多领域应用的参考文献,如下所呈。
增强细胞吸收(转染)
许多报告证实,在DEAE标记葡聚糖存在下,细胞对病毒核酸的吸收增强,而不会对细胞产生有害影响7–9。不过只有在较高浓度下,这种效应才会明显。
疫苗佐剂
阳离子标记葡聚糖在羊羔、牛犊和仔猪的兽用疫苗生产中的效用,相关报道数不胜数。10–12
基因治疗剂
许多报道描述了阳离子标记葡聚糖在基因治疗中的潜在应用。13
蛋白质储存稳定剂
DEAE葡聚糖已被证明能稳定冻干蛋白质(如酶)和蛋白质溶液。进一步的改进可以通过DEAE标记葡聚糖和多元醇组合使用来实现。14-17
给药制剂
阳离子葡聚糖与聚阴离子的静电结合特性已经证实,并通过调节药物在体内吸收,用于药物和药物类似物的给药18–20 。近期的研究深入探讨了各种影响络合物形成和性质的因素。21,22
絮凝剂
许多阳离子多糖在较佳用量下表现出较高的絮凝效率。聚阳离子的电荷密度决定了澄清度23。
胆汁酸螯合剂
研究了不同胆汁酸与季铵取代葡聚糖凝胶的结合。发现其结合常数是其他商业树脂的20倍以上24。
产品列表
|
产品编号
|
品名
|
分子量(kDa)
|
包装
|
|
|
Q-dextran 4
|
4
|
10 g
|
|
|
100 g
|
|
|
Q-dextran 10
|
10
|
10 g
|
|
|
100 g
|
|
|
Q-dextran 20
|
20
|
10 g
|
|
|
100 g
|
|
|
Q-dextran 70
|
70
|
10 g
|
|
|
100 g
|
|
|
Q-dextran 150
|
150
|
10 g
|
|
|
100 g
|
参考文献
1. M. Antonietti, Intrinsic viscosity of small spherical polyelectrolytes: Proof for the intermolecular origin of the polyelectrolyte effect; J Chem. Phys. 1996, V105, P7795 CAPLUS
2. M.Antonietti, Solution Viscosity of Polyelectrolyte-Surfactant Complexes: Polyelectrolyte Behavior in Nonaqueous Solvents, Macromolecules 1995, V28, P2270 CAPLUS
3. M. Antonietti, Quantitative description of the intrinsic viscosity of branched polyelectrolytes, Macromolecules, 1997, V30, P2700 CAPLUS
4. L.G.Ahrgren and A.N.de Belder, Dextran or cross-linked dextran having quaternary aminogroups, E.P. 66135, 1982; U.S. 4,591,638 , 1986.
5. T.Heinze, v.Haack and S.Rensing, Starch derivatives of high degree functionalization. 7. Preparation of cationic 2-hydroxypropyltrimethylammonium chloride starches, Starch/Stärke, 2004, 56, 288-296
6. A.Ebringerová, Z.Hromádková, M.Kacuráková etal., Quaternized xylans; synthesis and structural characterization, Carbohydr. Polym., 1994, 24, 301-308.
7. L.Ghimici, M. Nichifor, and B. Wolf, Ionic Polymers Based on Dextran: Hydrodynamic Properties in Aqueous Solution and Solvent Mixtures J. Phys. Chem. B, 2009, 113(23), 8020-80.
8. R.F.Selden, Transfection using DEAE-dextran, Curr.Protoc.Immunol., 2001, chap.10: Unit 10.14.
9. T.Gulick, Transfection using DEAE-dextran, Curr.Protoc.Immunol., 2001, chap.9: Unit 9.2.
10. J.S.Pagano and A.Vaheri, Enhancement of infectivity polio virus RNA with DEAEdextran, Arch.Gesamte Virusforsch., 1965, 14, 456-464,
11. M.Fiala and B.Salzman, Enhancement of rhinovirus ribonucleic acid by DEAEdextran, Appl. Microbiol., 1969, 17, 190-191.
12. S.I.Westbrook and G.H.McDowell, Immunization of lambs against somatotropin release inhibiting factor to improve productivity; Comparison of adjuvants, Aust.J.Agric.Res., 1994, 45, 1693-1700.
13. K.J.Beh and A.K.Lascelles, The effect of adjuvants and prior immunization on the rate and mode of uptake of antigen into afferent popliteal lymph from sheep, Immunol., 1985, 54, 487-495.
14. M.Hibma and J.F.T.Griffin, The effect of adjuvants on active and passive immunityn pregnant deer and their offspring, Vet.Immunol.Immunopath., 1992, 31, 279-287.
15. J.M.Kaplan, et al., Hum.Gene Ther., 1998, 9, 1469-79.
16. S.Liptay, H.Weidenbach, et al., Digestion, 1998, 59, 142-14.
17. L.Feng, L.Zhang et al., Roles of dextrans on improving lymphatic drainage for liposomal drug delivery, J.Drug Target., 2010, 18(3), 168-78.
18. F.Uchiumi, T.Watanabe and S.Tanuma, Characterisation of various promoter regions of the human DNA helicase-encoding genes and identification of duplicated ets(GGAA) motifs as an essential transcription regulatory element, Exp.Cell Res., 2010, 316(9), 1523-34.
19. T.D.Gibson, Protein stabilisation using additives based on multiple electrostatic interactions, Dev.Biol.Stand., 1996, 87,207-17.
20. V.G.Gavalas, N.A.Chaniotakis and T.D.Gibson, Improved operational stability of biosensors based on enzyme-polyelectrolyte complex adsorbed into a porous carbon electrods, Biosens. Bioelectron., 1998, 13(11), 1205-11.
21. N.A.Chaniotakis, Enzyme stabilization strategies based on electrolytes and polyelectrolytes for biosensor applications, Anal.Bioanal.Chem., 2005, 378(1), 89-95.
22. US Patent 6,133,229 (2000)
23. Delivery Technologies for Biopharmaceuticals; Peptides, Proteins, Nucleic acids and Vaccines; Lene Jörgensen(ed), Wiley, 2009, p.343.
24. L.Feng, LZhang, M.Lui et al., Roles of dextrans in improving lymphatic drainage for liposomal drug delivery, J.Drug Target., 2010, 18(3), 168-78.
25. A.O.Abioye and A.Kola-Mustapha, Controlled electrostatic self-assembly of ibuprofen-cationic dextran nanoconjugates prepared by low energy green process – a novel drug delivery tool for poorly soluble drugs, Pharm.Res., 2014, Dec 20 (Epub).
26. D.Le Cerf, A.S.Pepin and P.M.Niang, Formation of polyelectrolyte complexes with DEAE-dextran; Charge ratio and mol. mass effect, Carbohydr. Polym., 2014, 113, 217-224.
27. Y.Kikuchi and K.Hori, Structure and properties of polyelectrolyte complex prepared from DEAEdextran and poly(sodium glutamate), Nippon Kagsku Kaishi, 1982, 5, 847-52.
28. L.Ghimici and M.Nichifor, Flocculation Properties of Some Cationic Polysaccharides, J. Macromol. Sc., Part B: Physics, 2009, 48(1), 106-113.
29. M. Nichifor, X.X.Zhu, W.Baille, et al., Bile acid sequestrants based on cationic dextran hydrogel microspheres. 2. Influence of the length of alkyl substituents at the amino groups of the sorbents on the sorption of bile salts, J. Pharm. Sc., 2001, 90(6), 681-689
西宝生物专业提供TdB葡聚糖及其衍生物、荧光标记多糖等产品,欢迎来电400-021-8158垂询!