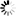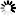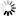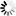摘要:研究人员首次发现了与退化相关的“分子标记”
研究人员首次发现了与退化相关的“分子标记”——细胞及其基因调节网络中可观察到的变化——这些标记在影响大脑不同区域的几种形式的痴呆症中是共有的。重要的是,加州大学洛杉矶分校领导的研究发表在《Cell》杂志上,还确定了不同形式的痴呆症的特异性标记,这些综合发现代表了在寻找病因、治疗和治愈方面的潜在范式转变。
“这项工作为神经退行性变的机制提供了新的见解,并为治疗方法的发展确定了新的候选途径,”资深和通讯作者Daniel Geschwind博士说。
 图1 单细胞基因组学揭示痴呆症的交叉疾病和疾病特异性途径
图1 单细胞基因组学揭示痴呆症的交叉疾病和疾病特异性途径以前的研究一次只关注一种疾病。这些研究被称为病例对照研究,它们将“患病”细胞与正常细胞进行比较,通常只关注大脑的一个区域。但在这项研究中,科学家们还观察了三种不同形式的痴呆症的分子变化,这些痴呆症可能涉及“tau病理学”,即在不同疾病的脆弱区域中异常tau蛋白的积累。
他们对超过100万个细胞进行了单细胞基因组分析,以确定三种相关疾病中不同的和共享的分子标记:阿尔茨海默病、额颞叶痴呆(FTD)和进行性核上性麻痹(PSP)。除了验证先前在阿尔茨海默氏症中观察到的变化之外,他们还确定了几十种细胞类型,这些细胞类型的变化在多种痴呆症中是共同的,还有几种细胞类型的疾病变化是特定于一种疾病的,其中许多以前没有被发现。
加州大学洛杉矶分校大卫·格芬医学院人类遗传学、神经病学和精神病学教授,加州大学洛杉矶分校健康中心精确健康研究所所长Daniel Geschwind医学博士说:“不同的情况有不同的退化模式。我们认为,除了典型的病例对照比较外,对不同疾病的病例进行比较,将有助于确定神经退行性变的共同组成部分,并了解所有这些疾病背后的细胞类型特异性变化。大多数研究只分析了一个大脑区域——典型的是额叶。在痴呆症和更普遍的神经退行性疾病中,特定的大脑区域和细胞在每种疾病中都是最脆弱的。这就是导致不同疾病的不同症状和体征的原因。由于区域脆弱性是这些疾病的核心特征,我们认为研究多个区域会带来新的见解,事实也确实如此。除了识别共享和独特的分子标记外,我们还展示了遗传风险与大脑中改变的这些疾病特异性途径之间的关系。”
利用这种研究设计,研究人员发现了四个基因,这些基因标记了所有三种疾病的脆弱神经元,突出了可用于开发新治疗方法的途径。
加州大学洛杉矶分校David Geffen医学院神经病学和神经行为遗传学助理教授、第一作者Jessica Rexach说这项工作“深刻地改变了”她对潜在疾病易感性机制的看法。“我们发现了几种截然不同的分子差异,这些差异将患有一种痴呆症的人的细胞与患有密切相关疾病的人的细胞区分开来,这是一件了不起的事,也令人感到谦卑。尽管这些疾病特异性差异只是患病大脑中观察到的少数变化,但它们与遗传性密切相关。这一令人惊讶的发现为理解某些基因为什么以及如何影响患一种脑部疾病的风险而不是另一种密切相关的疾病开辟了新的途径。”
阿尔茨海默病、FTD和PSP总共影响了全球2800多万人。尽管对阿尔茨海默氏症进行了广泛的研究,但目前还没有治愈方法,而且现有的已批准的药物只能减缓疾病的进展。很少有临床试验可用于FTD和PSP。
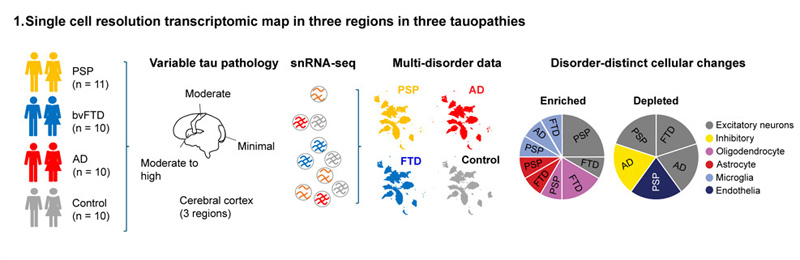 图2 三种tau蛋白病三个区域的单细胞分辨率转录组图谱
图2 三种tau蛋白病三个区域的单细胞分辨率转录组图谱Rexach说:“我们已经创建了一个广泛的数据资源,为识别和探索神经退行性痴呆的新治疗候选者铺平了道路。我们已经确定了特定的分子,现在可以在实验系统中作为潜在的新型疾病调节剂推进-重要的是,基于主要的人类疾病数据。此外,我们发现了意想不到的概念现象,可以解释为什么某些细胞对疾病表现出更强的弹性或脆弱性,我们渴望进一步研究这些发现。”
这项研究:
确定了阿尔茨海默病特有的独特变化,并证明了在阿尔茨海默病中也观察到其他疾病的一些发现,确定了治疗开发的目标。
发现“细胞恢复程序”——支持细胞对损伤作出反应的分子机制——在比较不同疾病的相同细胞类型时,激活或失败的方式不同。
我们惊讶地发现,这三种疾病中的每一种都在初级视觉皮层的细胞中发生了变化,初级视觉皮层是大脑中处理视觉信息的区域,被认为不受痴呆症的影响。在PSP中,这一发现揭示了以前未知的脑细胞星形胶质细胞的变化。
确定了PSP中某些tau相关基因和其他基因表达的特异性变化。这些似乎与PSP中观察到的独特的脑细胞退化模式有关。
作者们下一步将开始实验来验证他们的发现的因果性,他们预计这项研究将激发类似的交叉障碍研究。
“这些数据表明,已知的风险基因在特定的神经元和神经胶质状态或细胞类型中起作用,在相关疾病中存在差异。此外,因果相关的疾病状态可能仅限于特定的细胞类型和区域。这强调了在细胞水平上检查多个大脑区域以了解因果疾病途径的重要性,我们认为这为恢复力和脆弱性的共享和疾病特定方面提供了更清晰的图景,从而为治疗路线图提供信息。”
参考资料
[1] Cross-disorder and disease-specific pathways in dementia revealed by single-cell genomics.