细菌也成带路党!ACS NANO: 多功能菌基纳米酶实现肿瘤治疗精准打击
化学动力疗法(CDT)是一种通过肿瘤微环境(TME)内源性活性氧(ROS)破坏肿瘤细胞的治疗方法。然而,由于肿瘤自身的抗氧化能力以及靶向性等问题限制了CDT的进一步发展。略是提高CDT疗效的一种很有前途的方法,可以极大地降低其对肿瘤靶向的依赖,并大大降低副作用。
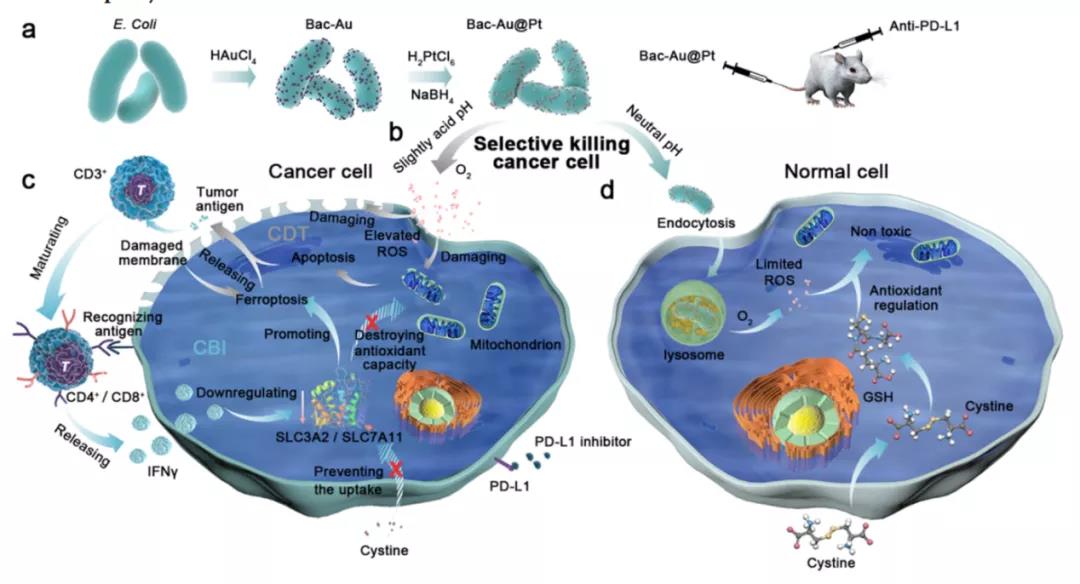
2021年12月,来自南洋理工大学和华中农业大学的研究团队在《ACS NANO》发表了题为“Precise Chemodynamic Therapy of Cancer by TrifunctionalBacterium-Based Nanozymes”的文章,报道了金和铂金属复合物(Au@Pt)修饰到细菌表面(Bac-Au@Pt)得到的新型多功能<纳米酶系统,此纳米酶系统可以作为一种反应温和、副作用小的新型药物对癌症进行精准化学动力学治疗。
由于细菌对肿瘤的靶向能力和Au@Pt纳米酶在酸性条件下的催化特性,该纳米系统可以有效地向肿瘤细胞释放ROS。此外,该纳米酶系统还可以刺激T细胞释放干扰素γ,特异性地降低肿瘤细胞内的抗氧化性。这种纳米系统使化学动力学治疗(CDT)和免疫治疗互相协同,低剂量的Bac-Au@Pt在免疫治疗的协同作用下也能实现高抗癌效果,是一个非常有潜力的治疗方案。

本研究中,研究者们在大肠杆菌表面合成了Au@Pt核壳结构,构成了纳米酶系统(称为Bac-Au@Pt),用于B16-F10黑素瘤小鼠模型的细菌诱导免疫治疗和精准化学动力学治疗。纳米系统给药后,Au@Pt纳米酶在微酸性的肿瘤微环境中产生ROS,然后启动肿瘤细胞的凋亡程序,释放肿瘤抗原并将其呈递给T细胞。在这一过程中,成熟的T细胞释放干扰素γ到肿瘤细胞并阻止胱氨酸的摄取,破坏肿瘤细胞的抗氧化能力,增加了ROS对肿瘤细胞的毒性,从而达到了高度精确的治疗效果。
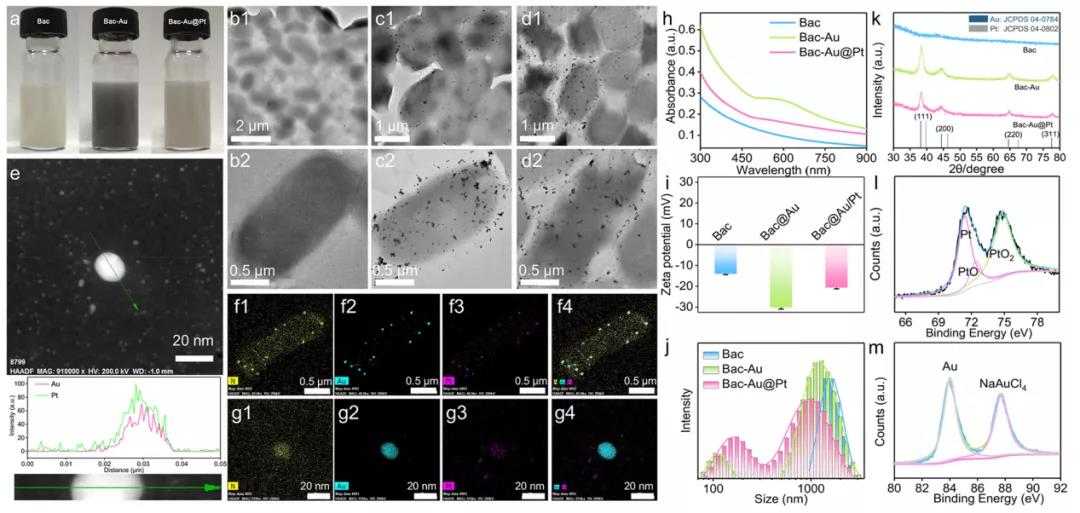
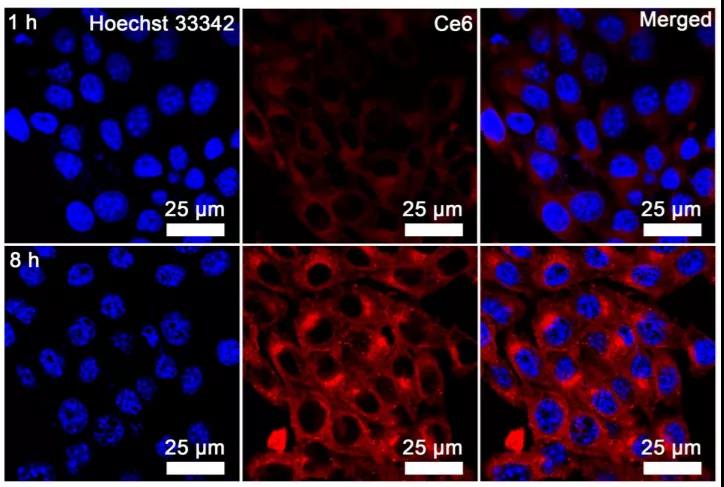
首先,研究者们使用大肠杆菌(e.c oli)在厌氧条件还原氯金酸,在其表面生成了Au纳米颗粒。在此过程中加入H2PtCl6、柠檬酸钠和NaBH4,Au纳米粒子表面覆盖了一层很薄的Pt。通过高角环形暗场扫描透射电子显微镜对Pt层的存在进行了表征,Pt元素的分布与Au元素的分布重叠,证明了Pt层在Au纳米颗粒上的原位生长。此外,研究者们还分别用紫外吸收光谱、DLS、XRD、XPS等手段对细菌(Bac)、细菌+金(Bac-Au)和细菌+Au@Pt(Bac-Au@Pt)材料进行了表征,充分证明了多功能菌基纳米酶系统的成功合成。在成功制备Bac-Au@Pt后,研究者们通过共聚焦激光扫描显微镜(CLSM)研究Bac-Au@Pt的细胞摄取,结果显示Bac-Au@Pt在8小时内被细胞内吞。
随后,研究者们用Bac-Au@Pt在酸性溶液中加入3,3,5,5 -四甲基联苯胺(TMB)检测ROS的产生。在不加入H2O2的情况下,从紫外可见光谱中可以看出,282 nm处的峰随着孵育时间的延长而减少,370和652 nm处的峰随着孵育时间的延长而增加。这说明了TMB的快速氧化,表明Bac-Au@Pt产生了催化ROS。然后,比较pH为6.4和7.4时产生的ROS数量,并记录652 nm处的吸收值,以表示TMB的氧化程度。结果表明,当pH为6.4时,Bac-Au@Pt能快速氧化TMB,产生的ROS量比pH为7.4时增加6倍。
为了明确Bac-Au@Pt产生的ROS种类,研究人员记录了Bac-Au@Pt在磷酸缓冲液(pH6.4和7.4)中的电子自旋共振(ESR)谱。如图2c、d所示,检测到超氧自由基和单线态氧升高。由于上述试验中没有添加H2O2,所以ROS的产生应归因于Bac-Au@Pt的溶解氧催化转化。
由于肿瘤组织微环境为微酸性,酸性溶液环境中具有较高ROS生成率更适合于肿瘤化学动力学治疗。研究者们在体外研究了Bac-Au@Pt的CDT效率。实验表明,>在中性条件下,Bac-Au@Pt对4种细胞株处理24或48小时后的所有细胞的存活率也接近100%,显示出良好的的体外生物相容性。Bac-Au@Pt的细胞毒理学实验表明:Bac-Au@Pt在pH为6.4时能有效产生ROS,引起细胞膜脂质过氧化损伤,是杀死癌细胞的关键因素。而在pH 7.4时,BacAu@Pt的脂质过氧化损伤是有限的,因此在中性pH (pH 7.4)时,Bac-Au@Pt不会对正常组织造成损伤。此外, pH 6.4环境中,细胞的线粒体被BacAu@Pt产生的ROS破坏,而在正常生理环境中,线粒体保持完整。
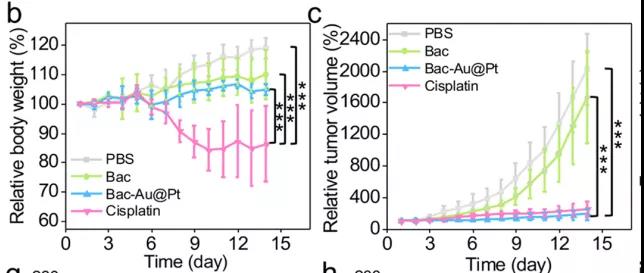
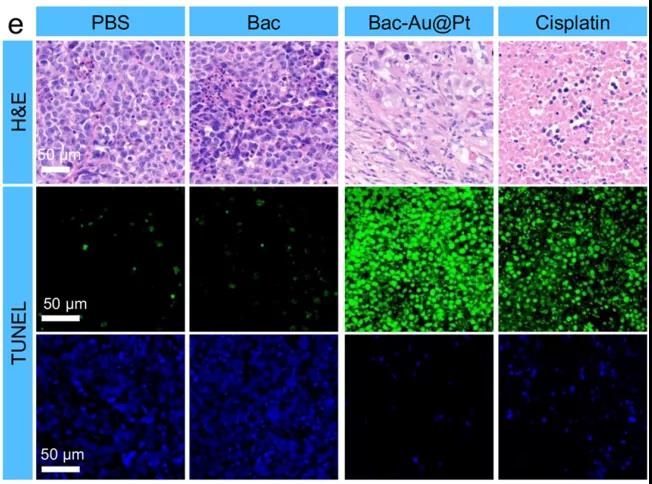
研究者们还进行了Bac-Au@Pt体内化学动力疗法的实验。首先,研究者们选择了缺乏正常的免疫系统的Babl/C裸鼠,排除了任何潜在免疫作用。研究者们对这些小鼠模型进行了14天的治疗,数据表明:对照组(PBS组和Bac组)肿瘤生长迅速,而治疗组肿瘤抑制成功。PBS、Bac、Bac-Au@Pt组小鼠在治疗期间体重在正常范围内波动,而顺铂组(cisplatin)小鼠体重持续下降,Bac-Au@Pt组小鼠的肿瘤体积和重量明显小于PBS组和Bac组。因此,顺铂虽然具有与Bac-Au@Pt相似的抗肿瘤作用,但对小鼠有明显的副作用,造成小鼠体重明显下降。不仅如此,收集小鼠组织进行组织病理学分析发现,根据肿瘤组织苏木精和伊红(H&E)染色,治疗组细胞核数量明显减少,说明Bac-Au@Pt和顺铂治疗效果显著。通过末端脱氧核苷酸转移酶介导的荧光素标记(TUNEL)实验显示,蓝色荧光减少,绿色荧光显著增加,表明肿瘤细胞凋亡处于晚期。
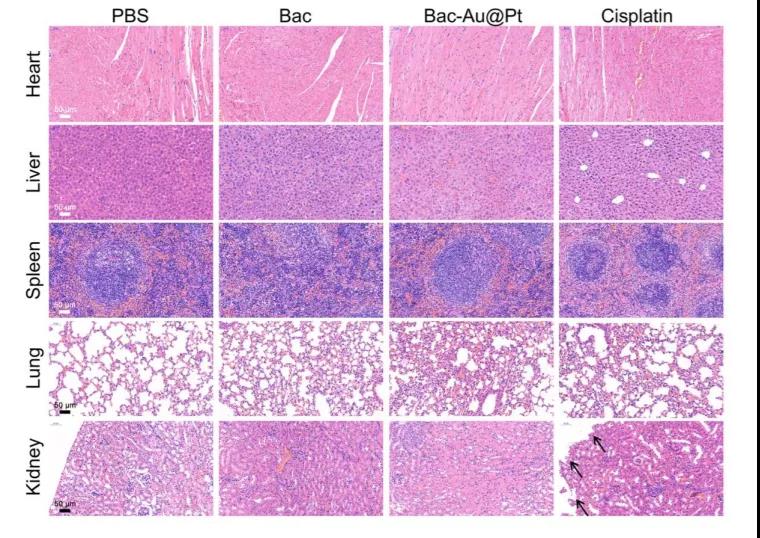
研究者们为验证Bac-Au@Pt的生物安全性,测定了其在器官中的Au元素含量。结果显示,金元素在心脏(0.89%ID/g)、肝脏(2.11%ID/g)、脾脏(1.68%ID/g)、肺(1.13%ID/g)和肾脏(1.86%ID/g)中残留很低。这些结果表明,大多数Au@ Pt纳米颗粒从体内被消除。研究者们还观察Bac-Au@Pt对小鼠肝肾功能的影响。血清中谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST)、白蛋白/球蛋白(A/G)水平与肝功能相关,尿酸(UA)、尿素氮(BUN)水平与肾功能相关。尽管Bac-Au@Pt在肝脏和肾脏有较高的积累,Bac和Bac- au@ Pt治疗组的ALT、AST、A /G、UA和BUN水平与PBS组相似。这些结果表明Bac-Au@Pt在治疗期间没有可检测到的肝和肾损伤。而顺铂组AST和A/G值分别显著升高和降低,提示顺铂会导致肝功能损害。虽然顺铂和Bac-Au@Pt在肿瘤治疗中疗效相似,但Bac-Au@Pt的副作用远小于顺铂。
此外,研究者们还发现细胞内谷胱甘肽(GSH)是由细胞产生以应对氧化应激。因此,无论是正常细胞还是肿瘤细胞,都具有一定的天然抗氧化能力。T细胞会向肿瘤细胞释放IFNγ,从而阻断GSH的主要来源胱氨酸的摄取,降低肿瘤细胞的抗氧化能力。
总之,本研究开发了一种基于细菌的Au@Pt核壳纳米酶,通过化学动力学和免疫治疗相结合来解决进行肿瘤的精准化学动力学治疗。Bac-Au@Pt在血液循环过程中积累在肿瘤部位,在酸性条件下将溶解的氧气催化成超氧自由基和单线态氧。在此过程中,由于T细胞释放IFNγ,肿瘤细胞中GSH的含量大幅度降低,而正常细胞中GSH的含量保持不变。因此,ROS只破坏肿瘤细胞而不破坏正常细胞,显著提高了治疗效果,减少了副作用。因此,基于细菌的纳米酶平台的联合治疗策略是提高CDT疗效的一种很有前途的方法,可以极大地降低其对肿瘤靶向的依赖,并大大降低副作用。
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
此文关键字:肿瘤细胞
相关资讯
- 好消息!上海西宝生物修饰性PEG “买一送一”
- 研究揭示重要形态发生素BMP的分泌调控机制
- 2018年2月西宝员工生日会
- 纳他霉素Natamycin(CAS:7681-93-8)-西宝生物专业提供
- 提供PEG共聚物或嵌段共聚物系列产品技术转让或技术合成服务
- 糖尿病研究ELISA试剂盒 - - 疾病诊断及研究系列(2)
- 研究发现细胞再生肝组织无肿瘤发生
- 人类机体DNA中古老的病毒“入侵者”或帮助机体抵御感染
- 德国德乐 NBB-增菌培养液(NBB-B-AM)
- 利用酮类物质治疗阿尔茨海默病
新进产品
同类文章排行
- 清除人体内衣原体感染的关键钥匙
- iScience:一种对抗遗传性神经系统疾病的潜在途径
- 真的有可以中和所有已知COVID-19毒株的抗体?
- 细胞“废物”使抗癌的免疫细胞恢复活力!
- 男性注意!这种食品摄入过多会导致结直肠癌
- 无路可退!主食中的农药残留,可诱发阿尔茨海默病
- Cell出乎意料新发现:原来是这种“濒死体验”让癌细胞恶化
- 研究发现,冠状病毒的形状会影响其传播
- Science Advances新突破:快速高效生产人体免疫细胞的新方法
- 《Nature Genetics》确定10个克罗恩病相关基因
资讯文章
您的浏览历史