利用CRISPR/Cas9系统治疗HBV感染取得突破性进展
乙型肝炎病毒(HBV),简称乙肝病毒,是一种DNA病毒,属于嗜肝DNA病毒科(Hepadnavividae),可导致肝硬化和肝癌的发生,给全球带来严重的疾病负担。据世界卫生组织(WHO)报道,全球有20多亿人曾受到过乙型肝炎病毒(HBV)感染,大约3.5亿至4亿人罹患慢性乙肝病毒(HBV)感染,在亚洲和非洲发病率尤其高。我国的乙肝病毒感染率约60%-70%;乙肝表面抗原携带率约占总人口的7.18%,以此计算,全国约有9300万人携带乙肝病毒,其中慢性乙型肝炎患者约2000万例。
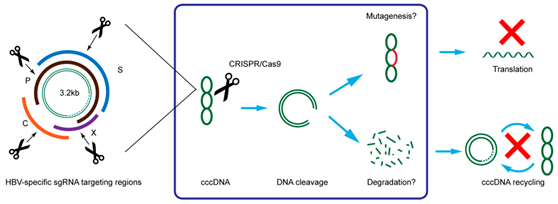
尽管现有的抗病毒药物可以控制乙型肝炎病毒,但却不能完全清除它。因此,一旦停止治疗患者肝脏中的HBV会重新活化。这是因为cccDNA “匿藏”在细胞核中。
细胞外的乙型肝炎病毒DNA是一种松弛环状的双链DNA(relaxed circularDNA,rcDNA)分子。HBV的基因组(rcDNA)进入到细胞核后,rcDNA在病毒蛋白和宿主细胞因子的帮助下修复成共价闭合环状DNA(cccDNA)。cccDNA是乙肝病毒前基因组RNA复制的原始模板。
只要还存在于肝细胞中,乙肝病毒cccDNA的复制就不会停止,并与病毒蛋白装配成新的完整HBV病毒颗粒,以芽生的方式再感染健康的肝细胞,而这是导致 乙肝复发的根本原因。因此,尽管每个肝细胞内只有约5~50个cccDNA拷贝,但是只要这些cccDNA池稳定,就可以使得病毒的持续感染延续,因而清 除肝细胞内的cccDNA是乙肝彻底治愈所必需的。
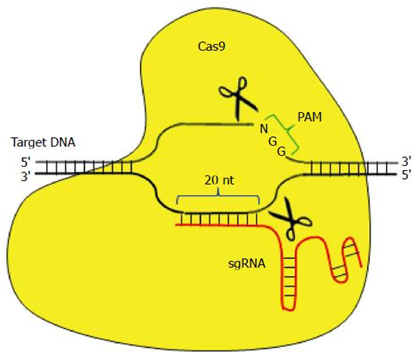
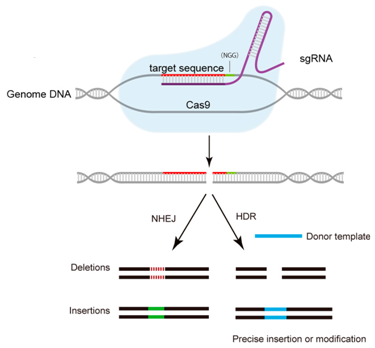
CRISPR/Cas9系统靶向结合特异性的DNA序列,诱导靶DNA双链发生精确切割。在哺乳动物细胞中,这样的切割能够被一种被称作非同源末端连接(non-homologous end-joining, NHEJ)的紧急修复系统快速地修复。NHEJ是高效的,但是并不很准确,因而经常导致一些DNA碱基在修复位点上插入或剔除。鉴于每次读取DNA时是按密码子(每个密码子由连续的三个碱基组成)读取的,在关键位点上发生的这些小的DNA序列变化经常破坏相应的基因和它的蛋白产物的功能。基于,世界各地的研究人员尝试利用CRISPR/Cas9系统治疗HBV感染,并且取得重大进展。
1. Sci Rep:利用CRISPR/Cas9系统高效地抑制HBV
Scientific Reports, 02 June 2015, doi:10.1038/srep10833
Scientific Reports, 02 June 2015, doi:10.1038/srep10833
在一项新研究中,麻省理工学院的研究人员利用CRISPR/Cas9 系统,对受到HBV感染的哺乳动物肝细胞进行基因组编辑,从中删除了乙肝病毒(HBV)DNA。他们靶向切割了HBV病毒共价闭合环状DNA(cccDNA)中的一些特异性位点。
在这项研究中,Vyas Ramanan和同事们设计了24条单向导RNA(sgRNA)来靶向从在线病毒序列信息资源库中鉴别出的一些HBV基因组位点。经过初筛测试后,研究小组将三种最有效的sgRNA和Cas9蛋白插入到慢病毒载体中,然后将它们转导进将HBV DNA整合到宿主基因组的人类肝细胞内。
通过利用包含整合性HBV基因组DNA的稳定转染细胞系展开实验,研究人员观察到HBV总DNA和cccDNA逐渐减少,在36天时cccDNA下降了92%。他们还观察到HBV病毒基因表达和复制水平显著减少。
如今,Ramanan计划在人类肝脏嵌合小鼠模型中测试这一方法,以评估和优化传递方法和给药方法,及更好地了解需要除去多少的cccDNA才能到达人类功能性的治愈。
2. Mol Ther Nucleic Acids:利用CRISPR/Cas9抑制HBV感染
Molecular Therapy Nucleic Acids, 2014 December; 3(12): e216, doi:10.1038/mtna.2014.68
Molecular Therapy Nucleic Acids, 2014 December; 3(12): e216, doi:10.1038/mtna.2014.68
在一项新的研究中,为了研究源自传染性HBV的cccDNA是否能够被直接靶向摧毁,来自美国福克斯蔡斯癌症中心(Fox Chase Cancer Cente)的研究人员在表达HBV受体---钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide, NTCP)---的人HepG2中使用CRISPR/Cas9基因编辑系统。他们测试了不同的HIV特异性的向导RNA(gRNA),并证实它们能够高达8倍地抑制HBV感染。这种抑制是HBV cccDNA发生突变和缺失---类似于Cas9切割染色体DNA和随后基于NHEJ介导的DNA修复时观察到的情形---所导致的。α干扰素(IFN-α)并不对CRISPR/Cas9系统的抗病毒活性产生可衡量的影响,这提示着Cas9和NHEJ活性并不受这种细胞因子(即IFN-α)诱导的先天免疫反应的影响。
3. Mol Ther:利用CRISPR/Cas9让HBV cccDNA功能性灭活
Molecular Therapy, online publication 21 June 2016; doi: 10.1038/mt.2016.94
Molecular Therapy, online publication 21 June 2016; doi: 10.1038/mt.2016.94
在一项新的研究中,通过采用下一代测序(NGS)技术,来自美国福克斯蔡斯癌症中心(Fox Chase Cancer Cente)的Christoph Seeger、Ji A Sohn和同事们确定了在Cas9切割和基于非同源末端连接(NHEJ)的修复后,HBV cccDNA所发生的完整突变谱。他们发现,90%以上的乙肝病毒DNA都能被Cas9切割。此外,研究结果还表明,在Cas9切割后对HBV DNA进行基因编辑的效率是在对被HBV感染的细胞进行α干扰素(IFN-α)处理后发生的APOBEC蛋白介导的胞嘧啶脱氨基作用的1500倍以上。研究还发现,以前用来检测DNA胞嘧啶脱氨基作用的3D-PCR方法方法高估了发生基因编辑的HBV DNA的数量和频率。
总之,研究人员证实CRISPR/Cas9系统是迄今为止在功能上让HBV cccDNA失活和提供一种慢性乙肝治愈疗法的最好途径。
4. Gene Ther:我国科学家利用CRISPR破坏乙肝病毒
Gene Therapy, 2015, 22, 404–412; doi:10.1038/gt.2015.2; published online 5 February 2015
Gene Therapy, 2015, 22, 404–412; doi:10.1038/gt.2015.2; published online 5 February 2015
2015年2月5日,来自我国军事医学科学院放射与辐射医学院研究所、第四军医大学西京医院、日本京都大学和华中农业大学兽医学院等处的研究人员,在Nature旗下Gene Therapy期刊上发表一项最新的研究成果,题为“Harnessing the clustered regularly interspaced short palindromic repeat (CRISPR)/CRISPR-associated Cas9 system to disrupt the hepatitis B virus”。
在这项研究中,研究人员研究靶向乙肝表面抗原(HBsAg)编码区的CRISPR/Cas9系统,在体外培养的肝细胞中和活的小鼠体内的效果。结果表明,CRISPR/Cas9可在体内和体外抑制HBV复制和表达,可能是治疗HBV感染的一种新策略。
5. Mol Ther Nucleic Acids:利用CRISPR/Cas9系统在体内促进肝内HBV模板清除
Molecular Therapy Nucleic Acids, 2014, 3, e186; doi:10.1038/mtna.2014.38
Molecular Therapy Nucleic Acids, 2014, 3, e186; doi:10.1038/mtna.2014.38
在当前的抗病毒治疗下,HBV cccDNA持续存在是根治慢性乙肝的一大障碍。治愈慢性乙肝需要新的策略来特异性地破坏HBV cccDNA。为了研究CRISPR/Cas9系统是否能够切割HBV基因组,来自中国国立台湾大学的研究人员设计出8种针对A基因型HBV的gRNA。
利用这些HBV特异性的gRNA,CRISPR/Cas9系统显著性地降低感染上HBV表达载体的Huh7细胞中的乙肝核心抗原(HBcAg)和乙肝表面抗原(HBsAg)产生。在这8种筛选出的gRNA中,他们鉴定出两种有效的gRNA。有趣的是,其中的一种靶向保守性HBV序列的gRNA在不同基因型的HBV中都能发挥作用。
利用一种流体动力学-HBV持续存在小鼠模型,研究人员进一步证实这种CRISPR/Cas9系统能够切割肝内含有HBV基因组的质粒,促进它在体内被清除,从而导致血液中的HBsAg水平下降。
利用一种流体动力学-HBV持续存在小鼠模型,研究人员进一步证实这种CRISPR/Cas9系统能够切割肝内含有HBV基因组的质粒,促进它在体内被清除,从而导致血液中的HBsAg水平下降。
这些数据提示着CRISPR/Cas9系统能够在体外和体内破坏HBV表达模板,并且表明它有潜力根除持续性HBV感染。
6. Virus Res:利用CRISPR/Cas9系统在体内和体外诱导抗HBV效应
Virus Research, Volume 217, 2 June 2016, Pages 125–132, doi:10.1016/j.virusres.2016.04.003
Virus Research, Volume 217, 2 June 2016, Pages 125–132, doi:10.1016/j.virusres.2016.04.003
在一项新的研究中,来自中国同济大学生命科学与技术学院的研究人员利用CRISPR/Cas9系统靶向剔除HBV基因组中的保守性区域。通过让核酸内切酶Cas9携带HBV S基因和X基因的同源序列,他们构建出pCas9。通过利用pCas9开展实验,他们证实pCas9-2能够更好抵抗HBV产生,而且在Huh7和HepG2细胞之间没有显著差异。
在M-TgHBV的HBV感染小鼠模型中,注射pCas9会降低血液中的HBsAg水平和肝脏中的HBcAg水平。
总之,这种人工构建的CRISPR/Cas9系统能够诱导抗HBV效应,而且有潜力作为一种新的疗法治疗慢性HBV感染。
7. Sci Rep:利用CRISPR/Cas9系统破坏HBV S基因和X基因保守性序列
Scientific Reports, 2015 Sep 3;5:13734. doi: 10.1038/srep13734
Scientific Reports, 2015 Sep 3;5:13734. doi: 10.1038/srep13734
为了在治疗上应用于人体,人工设计出的核酸内切酶Cas9应当能够识别不同基因型的HBV,同时产生最小的脱靶效应。
针对此,在一项新的研究中,德国研究人员鉴定出HBV基因组的S区域和X区域在不同基因型中都保守的HBV序列,而且能够利用一种Cas9酶特异性地和高 效地靶向切割这些保守性序列。这一方法不仅破坏报告细胞系中的游离HBV cccDNA和HBV在染色体上的整合靶位点,而且也破坏慢性感染和新感染的肝癌细胞系中的HBV复制。
这些数据提示着将CRISPR/Cas9系统作为旨在治愈HBV感染的新策略具有可行性。
8. World J Gastroenterol:利用双gRNA指导的CRISPR/Cas9系统高效地抑制HBV复制
World Journal of Gastroenterology, 2015 Aug 28; 21(32):9554-65, doi:10.3748/wjg.v21.i32.9554
World Journal of Gastroenterology, 2015 Aug 28; 21(32):9554-65, doi:10.3748/wjg.v21.i32.9554
为了筛选和研究有效地抵抗A、B、C和D基因型HBV的gRNA,来自中国北京大学医学部的研究人员总共设计出15种gRNA(分别记为gRNA-1,gRNA-2,…,gRNA-15)。他们从中选择了11种靶向HBV基因组调节区域的双gRNA组合。他们研究了每种gRNA和这11种双RNA组合抑制A、B、C和D基因型HBV复制的效率。
研究人员证实所有的gRNA能够显著地抑制体外细胞培养物中的HBsAg或HBeAg产生,所有双RNA组合能够高效地抑制A、B、C和D基因型HBV中的HBsAg或HBeAg产生,而且当与单个gRNA相比时,双RNA组合抑制HBsAg或HBeAg产生的效率显著增加。
再者,通过利用PCR直接测序,研究人员证实这些双gRNA组合能够通过移除这两种使用的gRNA的切割位点之间的序列片段,特异性地破坏HBV表达模板。最为重要的是,gRNA-5和gRNA-12的双gRNA组合不仅能够高效地抑制HBsAg和/或HBeAg产生,而且也破坏HepAD38细胞中的HBV cccDNA池。
这些结果提示着CRISPR/Cas9系统能够高效地破坏HBV表达模板(A、B、C和D基因型HBV),而且没有明显的细胞毒性。
9. J Gen Virol:利用CRISPR/Cas9系统抑制不同基因型HBV复制
Journal of General Virology, 2015 Aug;96(8):2252-61, doi:10.1099/vir.0.000159
Journal of General Virology, 2015 Aug;96(8):2252-61, doi:10.1099/vir.0.000159
为了研究利用CRISPR/Cas9系统是否可能破坏HBV DNA模板,来自中国武汉大学的研究人员设计出8种靶向不同基因型HBV的保守区域的gRNA,而且这些gRNA能够在体外和体内显著地抑制HBV复制。
再者,这种HBV特异性的gRNA/Cas9系统能够抑制不同基因型HBV在细胞中的复制,而且利用单个gRNA/Cas9系统能够显著降低HBV DNA,而且利用不同的gRNA/Cas9系统组合能够清除HBV DNA。
10. Antiviral Res:利用CRISPR/Cas9系统高效抑制HBV复制
Antiviral Research, Volume 118, June 2015, Pages 110–117, doi:10.1016/j.antiviral.2015.03.015
Antiviral Research, Volume 118, June 2015, Pages 110–117, doi:10.1016/j.antiviral.2015.03.015
作为一种新的基因组编辑工具,CRISPR/ Cas9系统能够被用来准确地和高效地改造和修饰基因组DNA。
在一项新的研究中,来自中国苏州大学的研究人员合成出4种靶向HBV基因组保守区域的单向导RNA(sgRNA)。在Huh7细胞和HBV复制性细胞HepG2.2.15中,CRISPR/Cas9系统降低HBV产生。他们进一步证实CRISPR/Cas9的直接切割和这种切割介导的突变发生于转染细胞的HBV cccDNA中。
在携带HBV cccDNA的小鼠模型中,通过快速地尾静脉注射含sgRNA-Cas9的质粒导致较低水平的HBV cccDNA和HBV蛋白产生。
总之,这种CRISPR/Cas9系统能够准确地和高效地靶向HBV cccDNA和抑制HBV复制。它有可能被用来治疗慢性HBV感染。
11. Virology:利用CRISPR/Cas9系统抑制HBV DNA积累
Virology, Volume 476, February 2015, Pages 196–205, doi:10.1016/j.virol.2014.12.001
Virology, Volume 476, February 2015, Pages 196–205, doi:10.1016/j.virol.2014.12.001
在一项新的研究中,来自美国杜克大学和埃默里大学的研究人员通过对细菌Cas9基因和单向导RNA(sgRNA)进行慢病毒转导,观察到在体外的HBV慢性感染和新感染的模型中,HBV DNA产生受到高效抑制。HBV特异性的Cas9/sgRNA组合降低总HBV DNA水平高达1000倍左右和降低HBV cccDNA水平高达10倍左右,而且也通过突变让残留的绝大多数HBV DNA失活。
总之,这些数据提供概念验证表明CRISPR/Cas9系统有潜力有效地剔除慢性HBV感染者体内的HBV cccDNA池。
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
下一篇:新研究在干细胞中找到“不老之泉”的奥秘上一篇: 寻找阿尔茨海默病早期标志物
此文关键字:CRISPR/Cas9|HBV|乙型肝炎
相关资讯
- 痛经药物“甲灭酸”可有效治疗阿兹海默症
- 人类胚胎干细胞重塑生物学概念并进入临床
- Science:新研究揭示VDAC蛋白寡聚体促进线粒体DNA释放和自身免疫反应
- PNAS:解读!科学家们有望利用一种新型的聚糖标记策略来揭秘肝脏中的免疫激活机制!
- 免疫组化实验过程中的要点和技巧
- 西宝生物生化诊断原料系列之诊断用酶底物
- 重大进展!开发出一种新的DNA合成方法
- 疾病诊断及研究用试剂盒优惠促销
- 高效液相色谱法(HPLC)测定黄曲霉素
- 生物降解塑料 - 聚羟基脂肪酸酯(PHA)
新进产品
同类文章排行
- 清除人体内衣原体感染的关键钥匙
- iScience:一种对抗遗传性神经系统疾病的潜在途径
- 真的有可以中和所有已知COVID-19毒株的抗体?
- 细胞“废物”使抗癌的免疫细胞恢复活力!
- 男性注意!这种食品摄入过多会导致结直肠癌
- 无路可退!主食中的农药残留,可诱发阿尔茨海默病
- Cell出乎意料新发现:原来是这种“濒死体验”让癌细胞恶化
- 研究发现,冠状病毒的形状会影响其传播
- Science Advances新突破:快速高效生产人体免疫细胞的新方法
- 《Nature Genetics》确定10个克罗恩病相关基因
资讯文章
您的浏览历史