Nature子刊:血管周围细胞诱发阿尔茨海默病相关的微胶质功能障碍
摘要:小胶质细胞是保护哺乳动物大脑的初级免疫细胞,部分是通过吞噬病原体和有毒碎片来实现的。最近的遗传学研究一直强调小胶质细胞在发育中的作用。
小胶质细胞是保护哺乳动物大脑的初级免疫细胞,部分是通过吞噬病原体和有毒碎片来实现的。最近的遗传学研究一直强调小胶质细胞在阿尔茨海默病(AD)和其他神经退行性疾病发展中的作用,表明它们可以异常地开始吞噬突触,神经元之间的关键连接。现在,伦敦大学学院(UCL)英国痴呆症研究所的研究人员进行了一项研究,旨在更好地了解小胶质细胞可以增加患AD风险的吞噬过程。
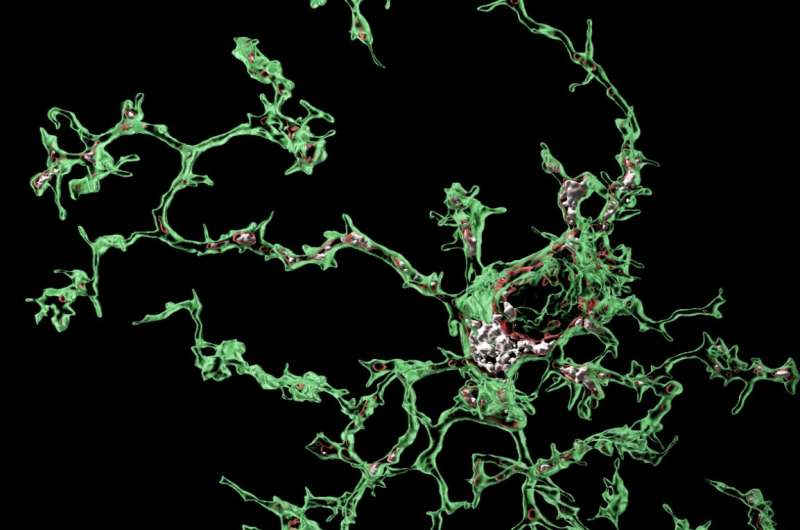
“在大脑发育的过程中,小胶质细胞吞噬突触需要被移除,才能使大脑正常连接,”该研究的小组负责人、通讯作者Soyon Hong博士说。“然而,当大脑遭受疾病或衰老时,小胶质细胞的这一关键功能可能会重新激活,导致异常的吞噬和突触的丢失。我们是第一批在模拟AD某些方面的小鼠模型中显示小胶质细胞以特定区域的方式过量摄取突触的团队之一。这是相关的,因为突触丧失是人类AD患者认知障碍的最强相关因素之一。”
虽然在AD小鼠模型中,阻断突触的小胶质细胞吞噬可以防止突触的丢失,但触发这种不良吞噬过程的信号仍然是一个谜。在这项发表在《Nature Neuroscience》杂志上的新研究中,由博士后科学家Sebastiaan De Schepper博士领导的团队揭示了小胶质细胞和邻近的血管周围巨噬细胞(一种排列在小血管上的细胞)之间前所未有的通信,发生在突触吞噬之前。

图1 研究人员揭示了小胶质细胞和邻近的血管周围巨噬细胞之间前所未有的通信
“我们发现了血管周围巨噬细胞在突触病理中的惊人作用,”De Schepper博士解释道。“在正常的大脑中,血管周围的巨噬细胞在血液中巡逻,寻找潜在的病原体,但现在看来,它们也对血管周围淀粉样蛋白的早期积累做出反应。”
β淀粉样蛋白是一种存在于大脑神经元细胞中的蛋白质。当这种蛋白质积累太多时,它会形成称为“斑块”的团块,这是AD的病理标志。
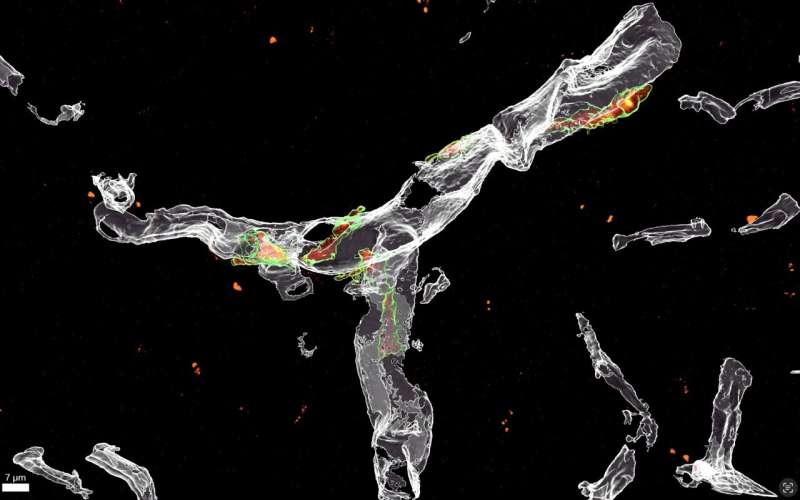
“然而,越来越清楚的是,β淀粉样蛋白在疾病早期聚集在血管周围,促使局部细胞,如血管周围巨噬细胞,启动免疫反应,”De Schepper博士补充道。
在AD小鼠模型中使用最先进的显微镜技术,De Schepper博士和Hong博士特别发现,这种免疫反应需要释放SPP1,或骨桥蛋白,一种作为免疫调节剂的糖蛋白,导致小胶质细胞吞噬突触的激活。De Schepper博士进一步解释说:“值得注意的是,SPP1此前已被发现在AD患者的脑脊液中高表达,但直到现在还不知道它的功能。血管周围巨噬细胞释放SPP1可能代表了预测大脑免疫系统如何对AD早期病理改变做出反应的新治疗途径。”伦敦大学学院的Hong实验室进行的这项研究的一个超额目标是精确定位导致早期AD患者突触丧失的小胶质细胞亚型。他们的新研究朝着这个方向又迈进了一步,因为它帮助他们阐明了一些与小胶质细胞功能脱轨有关的过程。
Hong博士解释说:“不同小胶质细胞和血管周围亚群的鉴定和表征将对AD中突触的保存具有重要的治疗意义。我们假设,一种潜在的亚型可能以促炎糖蛋白SPP1(骨桥蛋白)的高表达为特征。在体内,SPP1在多个器官中标记许多吞噬性巨噬细胞亚型。在大脑中,SPP1还标记参与吞噬的小胶质细胞和血管周围巨噬细胞,包括突触。”
随后使用单细胞RNA测序技术,这种方法使我们能够研究大脑单个细胞中活跃的基因。他们发现血管周围细胞通过SPP1主动指示小胶质细胞吞噬突触。在下一步中,他们使用遗传技术从小鼠中去除SPP1基因。这使他们能够确定SPP1的缺失是否可以阻止小胶质细胞吞噬重要突触的不受欢迎的过程。
事实上,来自缺乏SPP1的小鼠的小胶质细胞(“SPP1 -敲除小鼠”)被阻止吞噬突触,这表明这种蛋白质是发生小胶质细胞吞噬所必需的。这组研究人员最近收集的结果证实了以前的发现,暗示血管空间在AD中的中心作用。
Hong博士解释说:“我们的研究结果支持了早期的研究,这些研究强调了大脑中的血管细胞是淀粉样β蛋白沉积物早期形成的关键部位。这反过来可能引发SPP1的增加,这可能导致血管周围细胞向邻近的小胶质细胞发出信号,诱导与AD相关的突触过度进食。”
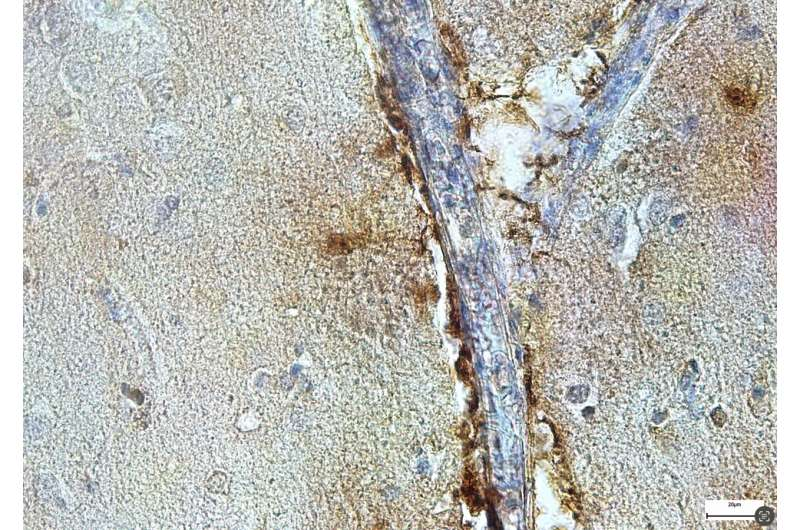
有趣的是,在他们的研究中,De Schepper博士和团队还在已故AD患者的海马血管周围细胞中检测到了SPP1,这意味着他们在小鼠身上的结果也适用于人类。因此,他们的发现可能很快就会为AD的新治疗干预的发展提供信息,这些治疗干预旨在通过血管周围空间调节小胶质细胞的活动。
“我们现在正在测试不同的方法来治疗AD早期阶段的SPP1,旨在防止大脑中的突触丧失和炎症,”De Schepper博士补充道。“一种方法是通过所谓的‘反义寡核苷酸’(ASO)。ASO是遗传物质的小片段,被设计成与体内特定的RNA分子结合。我们与Ionis制药公司一起开发了一种ASO,它专门与SPP1结合并干扰其产生,我们希望这将有助于将我们的发现转化为AD突触保存的新治疗方法。”
参考资料:
[1] Perivascular cells induce microglial phagocytic states and synaptic engulfment via SPP1 in mouse models of Alzheimer’s disease
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- 基因技术有助HIV疫苗开发
- Cell Rep:细胞衰老与年龄相关的血块有关
- 华人自述:感染新冠BA.5后咳血难忍,BA.5抗性是mRNA疫苗的4倍!迄今最糟糕的变异版本
- 食物中毒致病菌收集用磁石NH颗粒系列 O157、O26、O111
- 西宝生物邀您共赴第20届世界制药原料中国展(CPhI china 2020)盛会
- 西宝生物参展2016年慕尼黑上海分析生化展回顾
- 中国学者发现胃癌诊断潜在标志物 或有助于胃癌诊断治疗
- Science Advances新突破:快速高效生产人体免疫细胞的新方法
- Nat Com:最新研究找到调节心脏及肌肉关键蛋白的机理
- 乳糖/D-半乳糖[快速]检测试剂盒
新进产品
同类文章排行
- Nature子刊:血管周围细胞诱发阿尔茨海默病相关的微胶质功能障碍
- 是什么杀死了贝多芬?Cell子刊最新研究利用贝多芬的基因组找到了线索
- 确定了导致SARS-CoV-2感染的人类基因——CIART
- CAR-T疗法创始人PNAS发文:实体肿瘤治疗曙光出现?利用“组合拳”帮助T细胞
- 神经信号调节新发现:L-或D-氨基酸?镜像分子可改变神经元的信号!
- 一个全新的抗生素世界!Nature子刊报道单个噬菌体蛋白特性研究新方法
- 《科学》:诺奖得主解读 CRISPR 的十年
- 《Nature》甲流当季,大脑如何感知感染以及“布洛芬”没效果的原因?
- 修改mRNA或可治疗阿尔茨海默病
- Immunity:免疫系统的“马拉松选手”
资讯文章
您的浏览历史