摘要:新的研究表明,许多这些CRISPR筛选实验依赖于被称为CRISPR/Cas9向导的成分,这些成分在来自所有祖先的细胞中表现不佳。
CRISPR/Cas9基因编辑使大量生物医学实验成为可能,包括系统地关闭癌细胞中的基因以寻找癌细胞生存和生长严重依赖的基因的研究。这些基因,或“癌症依赖性”,通常是有希望的药物靶点。但是新的研究表明,许多这些CRISPR筛选实验依赖于被称为CRISPR/Cas9向导的成分,这些成分在来自所有祖先的细胞中表现不佳,这可能导致CRISPR筛选错过癌症依赖性。
这些CRISPR向导是RNA的短序列,引导CRISPR Cas9酶到达基因组中的特定位置,切割DNA并使目标基因失活。麻省理工学院博德研究所(Broad Institute of MIT)和哈佛大学(Harvard)的科学家们的新发现表明,这些指南中约有2%没有达到目标。这意味着Cas9不会切割并使特定基因失效,从而模糊了该基因在癌症生长中的潜在作用。研究小组发现,这种情况在来自非洲血统的人的细胞中发生得不成比例,因为CRISPR指南是使用来自主要是欧洲血统的人的参考基因组设计的,不能完全代表全球遗传多样性。
 图1 种系变异导致基于CRISPR的实验中的假阴性
图1 种系变异导致基于CRISPR的实验中的假阴性“这些不准确存在于我们可能不认识的地方,以我们无法预测的方式存在,”布罗德研究所的副成员、该论文的联合资深作者拉明·贝鲁克希姆(Rameen Beroukhim)说。该论文最近发表在《自然通讯》(Nature Communications)上。“这项工作表明,对我们正在使用的所有工具和数据集进行系统评估是非常值得的,这样我们就可以在这些隐藏的偏见成为问题之前解决它们。”
“CRISPR在临床前研究中被广泛使用,但只有少数研究人员仔细考虑与他们的模型系统相关的特定种系和祖先,这是对社区的一个警告,即功能基因组学并非不受祖先偏见的影响,并且是更仔细研究这类数据的机会来源。”
在他们的研究中,研究小组分析了Broad的癌症依赖图谱(DepMap)的数据,这是最大的癌症依赖资源,目前包括1000多个癌细胞系的全基因组筛选,其中约90%来自欧洲或东亚血统的人。
布罗德大学DepMap的主任弗朗西斯卡·巴斯克斯(Francisca Vazquez)说,DepMap中只有不到1%的细胞系引导对受到这项研究显示的祖先偏差的影响,但这些偏差对于在未来的图书馆中识别和修复是很重要的。在这些结果于2022年首次作为预印本发表后,DepMap团队从他们的库中删除了所有不起作用的引导rna,因此,数据库表明没有足够的数据来得出结论,而不是错误地返回受影响基因的依赖关系。
一种新的依赖项搜索
此前,对癌症依赖性的研究主要集中在人一生中某些细胞中出现的基因变化,即体细胞突变。但当博士后研究员、该研究的第一作者肖恩·米塞克(Sean Misek)于2020年加入Boehm和Beroukhim的实验室时,他想知道种系基因变异(遗传的,存在于全身所有细胞中)如何影响肿瘤对治疗的反应。
米塞克发现,祖先和遗传依赖性之间有许多强烈的联系,而这些联系大多来自与生殖系变异有关的人工制品。特别是,他在CRISPR指南中看到了这些影响。引导rna的序列与目标基因序列并不完全匹配,因为目标序列因祖先而异。
科学家们发现,基因组规模文库中89%的指南至少在一个细胞系中存在不匹配。他们还发现,非洲血统的人的细胞更容易出现不匹配。
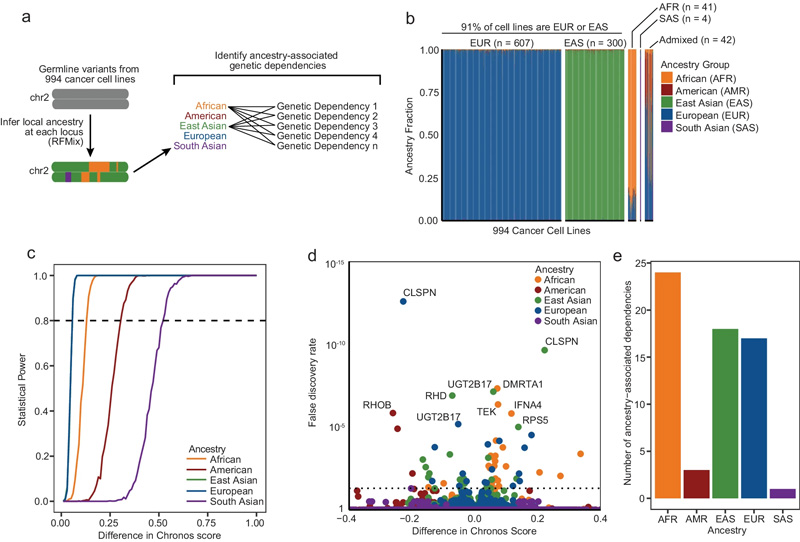 图2 鉴定与祖先相关的遗传依赖性
图2 鉴定与祖先相关的遗传依赖性“这类实验偏差可能在临床前研究中无处不在,”米塞克说。“我们希望这篇论文是更广泛讨论的一部分。”
了解研究项目中这种偏见的程度对科学家来说可能是一项挑战,因为下载所有必要的数据可能需要几天的时间。为了解决这个问题,Boehm, Beroukhim和Broad的Pattern团队建立了一个基于基因组聚集数据库(gnomAD)数据的网站,可以帮助研究人员确定祖先对他们选择的指南的影响。
“许多实验室在某种意义上使用CRISPR,他们应该有一种机制来检查他们的试剂,”米塞克说。“我们的目标是让人们更容易自己解决这个问题。”
教训
Boehm说,由于祖先的遗传变异对研究的影响远远超出了对癌症依赖性的研究,研究小组的发现对个体研究的影响程度将有所不同。Boehm说,尽管这种偏差的影响在DepMap中相对较小,但在只研究一种或少数细胞系的实验中可能会大得多。
展望未来,研究小组和DepMap的研究人员说,解决这种偏见的一个重要方法是增加大规模细胞系库的遗传多样性。巴斯克斯说:“我们鼓励社区向我们提供来自代表性不足人群的细胞系,如果他们有的话。”这是一个需要解决的非常重要的问题。”
参考资料
[1] Germline variation contributes to false negatives in CRISPR-based experiments with varying burden across ancestries