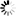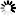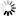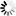Nature子刊:重大发现!科学家首次发现阿尔兹海默病和帕金森疾病的共通之处!
阿尔兹海默病和帕金森疾病并不相同,其影响着不同的大脑区域,而且有着不同的遗传和环境风险因子;但从生化水平来讲,这两种看似不同的神经变性疾病却有着相同的一面,近日,一项刊登在国际杂志Nature Structural and Molecular Biology上的研究报告中,来自埃默里大学的科学家通过研究就阐明了这两种疾病的共通之处,相关研究或为后期开发治疗两种神经变性疾病的新型疗法提供希望。

阿尔兹海默病和帕金森疾病的共通之处
图片来源:From Zhang et al NSMB (2017)
在阿尔兹海默病(AD)和帕金森疾病(PD)中,一种粘性蛋白会在大脑细胞中形成毒性聚集体,在AD中,细胞内部的“惹事鬼”是tau蛋白,其会组装形成神经原纤维缠绕体;而在PD中,罪魁祸首则是α-突触核蛋白,其会形成路易体(Lewy bodies);在此前研究中,研究者Ye和其同事通过研究鉴别出了名为天冬酰胺内肽酶(asparagine endopeptidase, AEP)的酶类,该酶能够对tau蛋白进行修饰使其更具粘性和毒性,因此,抑制AEP的药物往往在治疗阿尔兹海默病动物模型上能够表现出一定的效益。
这项研究中,研究人员通过研究发现,AEP似乎也能够以修饰tau蛋白的相同方式来对α-突触核蛋白进行修饰;在帕金森疾病种,α-突触核蛋白的行为同AD中的tau蛋白非常相似,因此研究人员就推断,如果AEP能够修饰tau蛋白,那么其是否也会以相同的方式来对α-突触核蛋白进行修饰呢?
随后研究人员通过研究,在PD患者脑组织样本中发现了由AEP修饰产生的α-突触核蛋白块状结构,但在对照样本中并未发现;在对照的脑组织样本中,AEP仅局限于溶酶体,其是细胞中负责垃圾处理的部分结构;但在PD样本中,AEP就会从溶酶体中渗出随后进入细胞的其它部位。研究者表示,相比全长蛋白而言,由AEP修饰产生的α-突触核蛋白块状结构更容易聚集形成团块结构,而且当其进入细胞或小鼠大脑组织后就更具毒性效应;此外,α-突触核蛋白会发生突变以便AEP酶无法对其修饰而降低其毒性。
最后研究者Ye提醒道,AEP并不是唯一一种能够切割α-突触核蛋白使其成为多种毒性片段的酶类,而且全长的α-突触核蛋白也会发生聚集从而对机体产生有害影响,尽管如此,后期研究人员还将通过更为深入的研究来检测抑制AEP的药物是否在帕金森疾病动物模型中能够发挥相应的治疗效应。
参考文献
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- Cell Rep:利用Sialyl-LewisX糖蛋白可识别在治疗期间潜藏的活跃HIV病毒库,为开发治愈HIV感染方法奠定基础
- 干细胞临床研究相关法规将出台 行业标准将更规范化
- Nature子刊:神秘蛋白质引发代谢紊乱分子机制
- 《第二类医疗器械经营备案凭证》(沪浦食药监械经营备201802号)
- 科学家研制新二维材料"硼墨烯"
- 2016年6月西宝生物参展中国上海举行的CPhI China & FiAC 2016
- 酵母β-葡聚糖检测试剂盒, Enzymatic Yeast β-Glucan Assay Kit, 货号:K-EBHLG
- 乙肝快速检测试剂在POCT中的应用及标准探讨
- 中国药企为何沦为青蒿素原料供给方?
- The Lancet:五种癌症一发现就是晚期 早筛早诊绝非空话!
推荐产品
新进产品
同类文章排行
- 清除人体内衣原体感染的关键钥匙
- iScience:一种对抗遗传性神经系统疾病的潜在途径
- 真的有可以中和所有已知COVID-19毒株的抗体?
- 细胞“废物”使抗癌的免疫细胞恢复活力!
- 男性注意!这种食品摄入过多会导致结直肠癌
- 无路可退!主食中的农药残留,可诱发阿尔茨海默病
- Cell出乎意料新发现:原来是这种“濒死体验”让癌细胞恶化
- 研究发现,冠状病毒的形状会影响其传播
- Science Advances新突破:快速高效生产人体免疫细胞的新方法
- 《Nature Genetics》确定10个克罗恩病相关基因
资讯文章
您的浏览历史