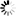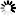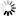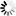摘要:先进的显微镜技术,让科学家们知道如何对抗一种导致全球抗生素耐药性细菌感染病例增加的酶。
细菌从武器库中汲取武器,以对抗旨在杀死它们的药物。这些武器中最普遍的是核糖体修饰酶。这些酶正变得越来越普遍,出现在世界范围内一系列耐药细菌的临床样本中。
现在,科学家们已经捕捉到了一类重要的酶的第一张图像。这些图像显示了酶是如何锁定在细菌核糖体上的一个特定位置,并像镊子一样挤压它,以提取RNA核苷酸并改变它。美国国家科学院院刊(PNAS)发表了由埃默里大学的科学家领导的研究结果。
 图1 酶是如何锁定在细菌核糖体上的一个特定位置
图1 酶是如何锁定在细菌核糖体上的一个特定位置先进的低温电子显微镜技术使超高分辨率的三维快照成为可能。
“眼见为实,”埃默里大学化学教授、该论文的共同通讯作者克里斯汀·邓纳姆(Christine Dunham)说。“当你在现实生活中看到生物结构在原子水平上相互作用的那一刻,就像在玩拼图游戏。你会看到每件事是如何结合在一起的,你会更清楚地知道事情是如何运作的。”
这些见解可能会导致设计新的抗生素疗法来抑制RNA甲基转移酶的耐药活性。这些酶将一种被称为甲基的小碳氢化合物从一个分子转移到另一个分子,这一过程被称为甲基化。
“甲基化是生物学中最小的化学修饰之一,”埃默里医学院生物化学教授、该论文的共同通讯作者格雷姆·康恩(Graeme Conn)说。“但这种微小的改变可以从根本上改变生物学。在这种情况下,它赋予细菌抵抗力,使其能够逃避一整类抗生素。”
康恩和邓纳姆也是埃默里抗生素耐药性中心的成员。
这篇论文的第一作者是Pooja Srinivas,他是埃默里大学分子和系统药理学研究生项目的博士候选人。后来她毕业了,现在是华盛顿大学的博士后。
邓纳姆是研究核糖体的权威专家。核糖体是一种复杂的结构,像细胞内的工厂一样运作,制造蛋白质。蛋白质是使细胞运转的机器,而DNA和RNA等核酸则储存着生命的蓝图。核糖体主要由RNA构成,RNA不仅储存信息,还可以作为酶,催化化学反应。
邓纳姆实验室的一个目标是找到操纵细菌核糖体的方法,使它们对抗菌剂更敏感。如果一种抗菌剂成功地使细菌核糖体失活,就会停止制造细菌生长和生存所必需的蛋白质。
这个想法是利用人类细胞核糖体和细菌核糖体的差异,这样只有细菌才能被抗菌药物靶向。
然而,抗菌剂需要通过细菌防御。
“这就像一场分子军备竞赛,”邓纳姆解释说。细菌不断进化出新的武器来抵御药物,而科学家们也不断进化出新的策略来解除细菌的武装。
Conn是细菌防御武器核糖体RNA甲基转移酶方面的领先专家。这个酶家族最初是在土壤细菌中发现的。它们现在越来越多地出现在人类和动物的细菌感染中,使这些感染更难治疗。
“它们在世界不同地区的一些令人讨厌的细菌病原体的临床样本中越来越频繁地出现,”Conn说。
这些酶可以使大肠杆菌、沙门氏菌、肺炎克雷伯菌、铜绿假单胞菌和肠杆菌科等病原体产生致命的耐药性。这种酶在细菌核糖体的特定位置添加一个甲基。这种添加物阻断了氨基糖苷类抗生素结合并产生抗菌作用的能力。
在《美国国家科学院院刊》的论文中,研究人员关注的是核糖体RNA甲基转移酶C (RmtC)家族中的罪魁祸首。
几十年来,研究人员一直依靠一种被称为x射线晶体学的技术来揭示分子机器在分子排列成晶体时如何工作的原子细节。
例如,2015年,邓纳姆的实验室通过x射线晶体学获得了一种名为HigB的酶如何撕裂RNA以抑制细菌生长的精确图像。通过抑制制造它的细菌的生长,HigB建立了一种休眠的“持久性细胞”状态,使细菌对抗生素产生耐受性。
研究人员的下一个任务是证明采用最佳递送策略的治疗方法也适用于带有特定基因融合的白血病小鼠。
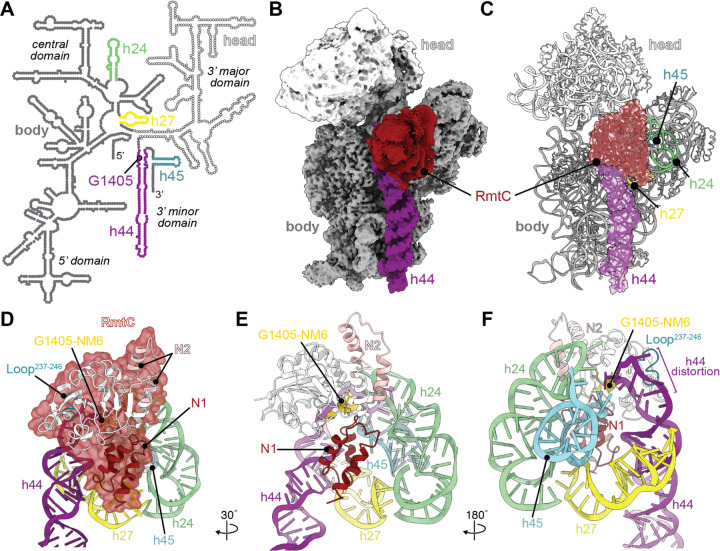 RmtC与保护性16S rRNA三维表面结合。
RmtC与保护性16S rRNA三维表面结合。然而,RmtC酶如何与核糖体相互作用的秘密却无法通过x射线晶体学得到。
“RmtC要复杂得多,”邓纳姆解释说。“从基础科学的角度来看,这是一种有趣的酶,因为它看起来与其他酶非常不同。”
低温电子显微镜的最新进展为放大RmtC的复杂机制打开了大门。
低温电子显微镜不需要结晶来揭示分子的结构和它们如何相互作用。相反,液体样品被迅速冷冻以形成玻璃状基质。玻璃状基质保留了分子的三维结构,并保护它们免受强电子束的破坏。
Meisam Nosrati是康涅狄格州实验室的前博士后研究员,也是PNAS论文的合著者,他制备了RmtC与大肠杆菌核糖体部分相互作用的样品。他利用了合著者林赛·科姆斯托克(Lindsay Comstock)的专业知识。科姆斯托克是维克森林大学(Wake Forest University)的化学家,他开发了一种技术,可以将酶捕获并稳定在所需的位置上。
然后,Nosrati将样品冷冻在一个小网格上,并将它们送到太平洋西北中心进行低温电子显微镜成像。
作为邓纳姆实验室的研究生,Pooja Srinivas随后分析和解释了显微镜数据集。她使用计算机算法将数千张单独的图像拼接在一起。结果将这些图像变成了一本展示RmtC复杂结构的翻页书。
“这种酶就像钳子一样锁在核糖体上,”邓纳姆解释说。“它会收紧控制,直到从RNA螺旋的内部挤出一个核苷酸。然后对核苷酸进行化学修饰。”
这种酶在与核糖体结合的位置上非常精确,核糖体是一种由50种不同的蛋白质和6000种不同的RNA核苷酸组成的大分子。
研究人员使用生物化学技术验证了他们的观察结果与先前的发现相吻合,即RmtC如何使细菌对靶向核糖体的氨基糖苷类抗菌剂产生耐药性。
研究人员现在正试图开发新的方法来对抗RmtC和相关酶的影响。
康恩说:“了解酶在进行化学反应时的形状,为我们提供了抑制其作用的新目标。”“例如,我们可以瞄准酶的钳形作用,试图阻止它挤压和结合到核糖体上。我们现在知道,这种酶在其表面形成一个口袋,小分子可能会在那里阻止这种作用。”
PNAS论文的其他共同作者是康涅狄格州实验室的研究科学家Natalia Zelinskaya和Debayan Dey。
这项工作的资金由美国国立卫生研究院和传染病发病机制Burroughs Wellcome基金研究员奖提供。
[1] 360 subunit recognition and G1405 modification by the aminoglycoside-resistance 16S riobsomal RNA methltransferase RmtC