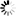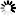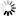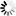新发现揭示:神经元是如何维持其通信能力的钙离子通道的?
摘要:神经元之间传递信号需要通过钙离子带动包裹了信号分子的小囊泡移动融合到下一神经元。钙离子通道是神经细胞信号交流的关键组分之一,那神经细胞是如何维持和调节这个钙离子通道的丰度和补给的?“可塑性”发生时这些钙离子通道会发生什么变化?
神经系统的运作是基于神经元之间通过被称为突触的连接进行信号交流。当钙离子通过离子通道进入充满了携带分子信息的小囊泡的“活性区”时,细胞之间得以“交谈”。带电的钙离子使小囊泡“融合”到突触前神经元的外膜,将用于交流的化学物质释放到突触后细胞中。在一项新的研究中,麻省理工学院Picower学习和记忆研究所的科学家们揭示了神经元是如何建立和维持这一重要基础设施的。
“钙离子通道是钙流入的主要决定因素,然后触发囊泡融合,所以它是突触前侧将电信号转换为化学突触传输的引擎的关键组成部分,”Troy Littleton说,他是这项新研究的高级作者,麻省理工学院生物、大脑和认知科学系的Menicon神经科学教授。“我们真的不清楚它们是如何在活性区积聚的。我们的研究揭示了活性区是如何积累以及调节钙离子通道丰度的线索。”“众所周知,突触前钙离子通道功能的调节具有非常重要的临床效果,了解这些通道如何调控的基础非常重要。”
神经科学家一直在寻找这些线索。理解这个过程可以帮助揭示神经元如何改变它们的沟通方式,这种被称为“可塑性”的能力是学习、记忆和其他重要大脑功能的基础。另一个原因是,像加巴丁这样的药物,可以治疗癫痫、焦虑和神经疼痛等多种疾病,它结合了一种与钙通道密切相关的名为alpha2delta的蛋白质。通过揭示更多关于alpha2delta的确切功能,该研究更好地解释了这些治疗的影响。
Cac的上限
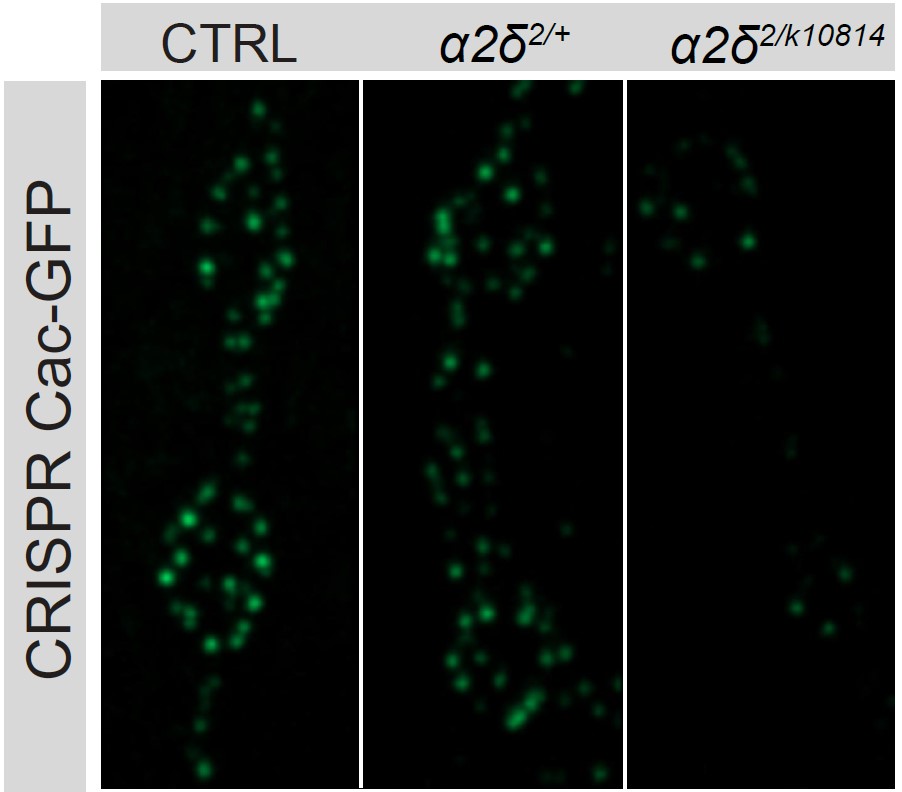
图片:科学家通过不同的操作敲除一种名为alpha2delta的蛋白质(右两列)越多,与未改变的对照组(左列)相比,
在苍蝇神经元突触活动区积累的Cac钙通道(亮度和绿点数量)就越少。
麻省理工学院博士后Karen Cunningham是论文第一作者,她利用果蝇运动神经元的模型系统,首次展示神经元活性区的钙离子通道是如何分布和维持的。Cunningham提出的第一个问题是在幼虫体内的发育中钙离子通道对活性区是否必要。但果蝇的钙离子通道基因(Cac)是如此重要,果蝇生命不能没有它。因此,Cunningham不能在果蝇中敲除Cac,而是使用了一种技术,只在一组神经元群体中敲除它。通过实验表明,即使没有Cac,活性区也能正常生长和成熟。
使用另一种人工延长果蝇幼虫阶段的技术,她还观察到,如果给予额外的时间,活性区将继续用一种名为BRP的蛋白质构建其结构,但Cac的积累在正常的6天后停止。Cunningham还发现,神经元中可用Cac供应的适度增加或减少并不影响每个活性区最终的Cac数量。更奇怪的是,她发现虽然Cac的数量确实与每个活性区的大小成比例,但即使她减少了活性区中的大量BRP,它只是轻微发生变化。事实上,神经元似乎对每一个活性区的Cac含量设定了一个稳定的上限。
Cunningham说:“这揭示了神经元活性区的结构蛋白有着非常不同的规则,比如随着时间的推移继续积累的BRP,而钙离子通道则受到严格的调控,其丰度被限制。”
定期更新
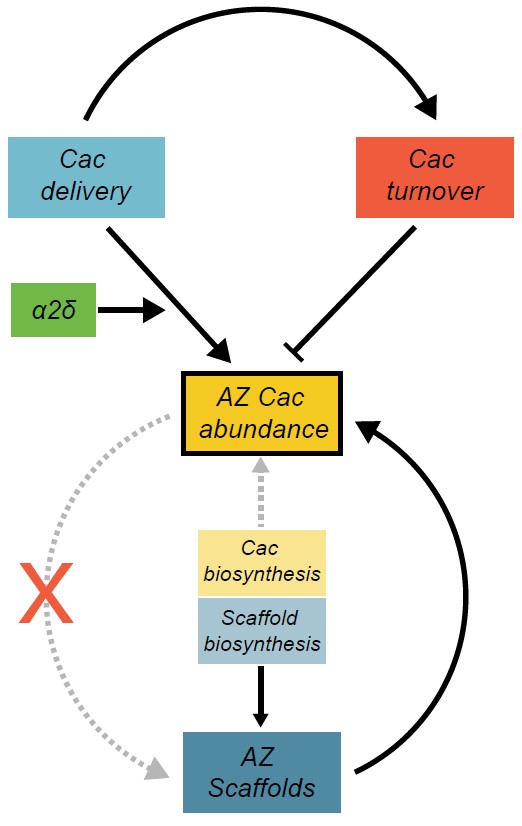
图2 该团队的模型显示了调节活跃区域Cac丰度的因子。活跃区框架构建和通过alpha2delta实现Cac传递增加了Cac丰度,
且周转率保持不变。而Cac的生物合成几乎没有增加丰度。
研究结果表明,除了Cac供应或BRP的变化之外,一定还有其他因素对Cac水平进行了如此严格的调节。Cunningham转向alpha2delta。当她通过基因控制这些物质的表达量时,她发现alpha2delta的水平直接决定了活性区积累的Cac量。
在进一步的实验中,Cunningham还能够证明,alpha2delta维持Cac水平的能力取决于神经元的总体Cac供应。这一发现表明,alpha2delta可能在Cac运输过程中发挥上游功能,向活跃区域供应和再供应Cac,而不是通过稳定Cac来控制活跃区域的Cac数量。
Cunningham使用了两种不同的技术来观察Cac补给的发生,测量了补给的程度和时间。在幼虫发育几天后她选择了一个时间来拍摄活性区的图像,并测量Cac丰度以确定全景。然后她通过漂白Cac荧光来消除它。24小时后重新观察Cac荧光,只突出显示在24小时内被送到活性区的新Cac。结果发现,当天几乎所有活性区域都有Cac递送,但一天的量与几天前积累的量相比确实只是一个零头。此外,她还发现较大的活性区比较小的活性区累积了更多的Cac。在alpha2delta突变的果蝇中,几乎没有新的Cac传递。
如果Cac通道确实能不断被补充,Cunningham想知道Cac通道从活性区移除的速度如何。为了确定这一点,她使用了一种染色技术,将一种名为Maple的光转换蛋白标记在Cac蛋白上,她可以在选定的时间用闪光改变颜色。通过这种方式,她可以首先看到在特定时间内积累了多少Cac(用绿色表示),然后闪光将Cac变成红色。当她在5天后再次查看时,发现大约30%的红色Cac已经被新的绿色Cac取代,这意味着30%的周转。当她通过突变alpha2 delta或减少Cac生物合成来降低Cac传递水平时,Cac周转停止。这意味着每天在活性区有大量的Cac周转,周转是由新的Cac交付推动的。
Littleton表示他们将在这些结果的基础上进一步研究。现在,钙离子通道丰度和补给的规则已经明确,他想知道当神经元经历可塑性时——例如当新的传入信息要求神经元调整它们的通信以扩大或减少突触通信时——钙离子通道会有何不同。他也渴望追踪单个钙离子通道如何在细胞体内产生然后沿着神经轴突向下移动到活跃区域,希望确定有其他哪些基因可能影响Cac丰度。
参考资料:
[1] New findings reveal how neurons build and maintain their capacity to communicate
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- Science子刊:揭示GCN2抑制肿瘤微环境中的抗肿瘤免疫反应
- GST标签蛋白纯化介质
- 生物技术服务-尽在西宝生物CRO专业服务平台
- WAKO发光试剂--腔肠素/Coelenterazine
- Cell重磅解读!科学家们成功在单细胞分辨率下解析机体肠道神经系统的奥秘!
- Cell:古老的酶AMCase保护哺乳动物免受肺部疾病
- DCP过氧引发剂
- CAR T疗法新突破!Nat Med背靠背发表两个研究团队发现避免细胞因子风暴的新方法
- CFDA公安部发布通知严打违法销售含可待因口服液
- 携带siRNA纳米颗粒可抑制肺癌细胞
新进产品
同类文章排行
- 清除人体内衣原体感染的关键钥匙
- iScience:一种对抗遗传性神经系统疾病的潜在途径
- 真的有可以中和所有已知COVID-19毒株的抗体?
- 细胞“废物”使抗癌的免疫细胞恢复活力!
- 男性注意!这种食品摄入过多会导致结直肠癌
- 无路可退!主食中的农药残留,可诱发阿尔茨海默病
- Cell出乎意料新发现:原来是这种“濒死体验”让癌细胞恶化
- 研究发现,冠状病毒的形状会影响其传播
- Science Advances新突破:快速高效生产人体免疫细胞的新方法
- 《Nature Genetics》确定10个克罗恩病相关基因
资讯文章
您的浏览历史