摘要:科学家们已经确定了一种治疗胶质母细胞瘤的潜在新策略
加州大学洛杉矶分校(UCLA)的科学家们发现了一种治疗胶质母细胞瘤(最致命的脑癌类型)的潜在新策略,即通过重新编程将具有侵略性的癌细胞转变为无害的细胞。相关研究结果发表在《美国国家科学院院刊》上,研究表明,将放疗与一种名为福斯可林的植物衍生化合物相结合,可以迫使胶质母细胞瘤细胞进入休眠状态,使其无法分裂或扩散。
在小鼠实验中,福斯可林与放疗的联合使用延长了生存期,为对抗胶质母细胞瘤提供了潜在的新途径。这种疾病治疗选择有限,确诊后的中位生存时间仅为15至18个月。UCLA放射肿瘤学教授、该研究的资深作者弗兰克·帕容克博士(Dr. Frank Pajonk)表示:“放疗虽然能有效杀死许多癌细胞,但也会诱导细胞的暂时性可塑性。我们发现了一种利用这种可塑性的方法,即使用福斯可林将这些细胞推向一种不分裂、类似神经元或小胶质细胞的状态。”
 图1 辐射诱导的细胞可塑性为胶质母细胞瘤提供了福斯可林介导的分化基础
图1 辐射诱导的细胞可塑性为胶质母细胞瘤提供了福斯可林介导的分化基础胶质母细胞瘤的治疗难度极大,主要是因为癌细胞具有不受控制的分裂能力,以及保护性的血脑屏障限制了治疗的有效性。目前的标准治疗方案——手术后进行化疗和放疗——在过去的二十年里一直没有改变。关键问题是胶质瘤干细胞在治疗后能够再生肿瘤并抵抗传统疗法,这是治疗失败的主要原因。
最近的研究发现,放疗不仅能够杀死一些胶质母细胞瘤细胞,还会使胶质瘤干细胞暂时变得更加灵活或更具适应性,为改变其身份提供了机会。基于这一概念,UCLA的研究人员决定研究放疗与福斯可林的联合使用。福斯可林是一种已知能够通过促进细胞分化为不分裂的神经元来影响细胞分化的药物化合物,与癌细胞不同,神经元不会不受控制地分裂。
该研究的第一作者、UCLA放射肿瘤学系助理项目科学家Ling He表示:“我们的方法之所以独特,是因为它利用了放疗的时机和效果。与传统的迫使癌细胞成熟的疗法不同,我们利用放疗创造一种暂时的灵活状态,使胶质瘤细胞更容易被引导成专业性更强、危害更小的类型。在适当的时机加入福斯可林,我们将这些细胞推向类似神经元或小胶质细胞的状态,减少它们重新长成肿瘤的潜力。”
为了测试福斯可林是否能够重新编程这些细胞,研究团队检查了联合治疗对细胞行为的影响,包括神经元标记物的表达、细胞周期分布和增殖情况。通过RNA测序分析基因表达的变化,而单细胞RNA测序则揭示了单个胶质母细胞瘤细胞如何转变为新的表型。通过限制稀释实验评估了对胶质瘤干细胞的影响。随后在小鼠模型中测试了这种方法以评估其改善生存能力的效果。
研究人员发现,福斯可林能够穿过血脑屏障,显著耗尽胶质瘤干细胞并减缓肿瘤增殖。这种治疗方法还显著减缓了小鼠的肿瘤生长,在某些情况下实现了长期的肿瘤控制。在高度侵袭性和快速生长的小鼠模型中,联合治疗将中位生存期从34天延长到48天。在侵袭性较低的胶质瘤小鼠模型中,联合治疗的中位生存期增加到129天,而仅接受放疗的小鼠中位生存期为43.5天。研究人员指出,所使用的亚致死剂量的放疗本身几乎没有任何效果。
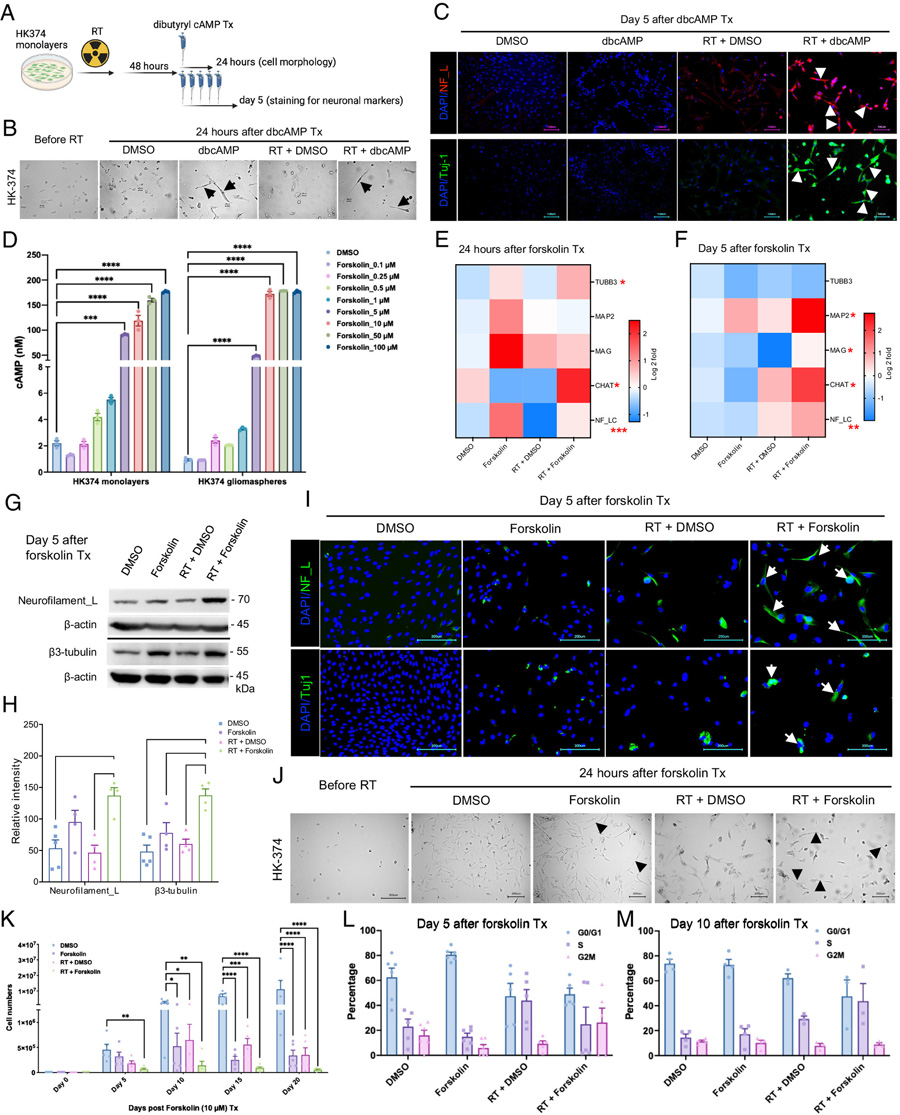
图2 dbcAMP或福斯可林诱导神经元标记物
Ling He表示:“这些发现突出了这种双重疗法在胶质母细胞瘤模型中显著提高生存率的潜力。”研究人员还惊讶地发现,胶质瘤细胞可以转变为类似小胶质细胞的细胞,这是一种大脑中的免疫细胞。通常,这两种细胞类型在发育过程中来自完全不同的起源。小胶质细胞来自中胚层,形成血液和免疫细胞等;而胶质瘤细胞被认为来自外胚层,形成大脑和神经细胞。然而,在肿瘤的独特环境中,这些癌细胞可以适应并在不同类型的细胞之间“转换身份”。
“我们的最终目标是有一天改变胶质母细胞瘤的治疗标准。通过靶向胶质瘤细胞的可塑性,并利用放疗诱导的多能状态,这项研究提供了一种有希望的策略,以扰乱肿瘤进展并提高患者生存率。”帕容克博士同时也是UCLA健康琼森综合癌症中心和UCLA干细胞研究与再生医学中心的成员。
尽管研究结果令人鼓舞,但研究人员观察到一些小鼠最终出现了复发,这强调了需要优化剂量并探索替代剂量策略,以提高肿瘤反应的长期持久性。
参考资料
[1] Radiation-induced cellular plasticity primes glioblastoma for forskolin-mediated differentiation
 蛋白酶K (源自林伯氏白色念球菌)
蛋白酶K (源自林伯氏白色念球菌) 茚三酮显色溶液套装,日立分析仪专用 (299-70501)
茚三酮显色溶液套装,日立分析仪专用 (299-70501) 氨基酸混合标准溶液,AN-2型 (011-14463)
氨基酸混合标准溶液,AN-2型 (011-14463) 表面润湿张力试验用混合液 Wetting Tension Test Mixture
表面润湿张力试验用混合液 Wetting Tension Test Mixture