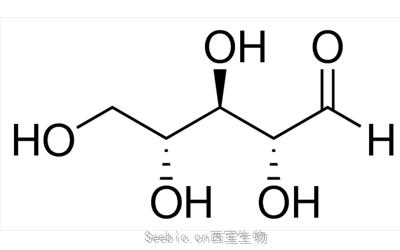
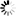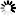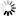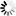高取代度硫酸葡聚糖
CAS 编号:9011-18-1
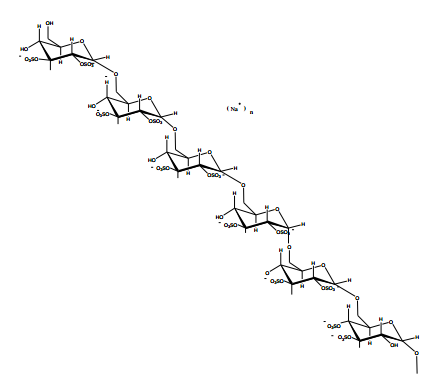
图1。高取代度硫酸葡聚糖片段的结构表征。高取代度硫酸葡聚糖,每单位葡萄糖大约含有两个硫酸基团,取代度为2.0。
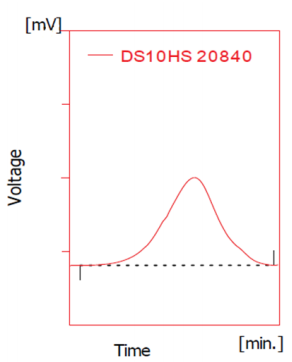
图2。典型的硫酸葡聚糖10分子量分布。硫酸葡聚糖馏分的尺寸用Mw、Mn和Mw/Mn来描述。通常由凝胶渗透色谱法确定,凝胶渗透色谱提供分子量分布的信息。
|
批号
|
取代度
|
Mw GPC
|
Mw LS
|
|
14D07B
|
0.82
|
124 000
|
115 000
|
|
14G32A
|
1.2
|
23 100
|
21 500
|
|
14G24B
|
1.92
|
12 800
|
10 400
|
|
14G12A
|
2.1
|
4 800
|
3 000
|
|
取代度
|
0.5M NaCl
|
0.15M NaCl
|
0.005M NaCl
|
|
Unsub.
|
0.27
|
0.264
|
0.258
|
|
0.02
|
0.25
|
0.263
|
0.281
|
|
0.23
|
0.236
|
0.262
|
-
|
|
0.37
|
0.224
|
0.252
|
-
|
|
1.58
|
0.353
|
0.224
|
-
|
|
1.9
|
0.36
|
0.22
|
-
|
|
Mol. Wt. Mw
|
[α]D, degrees
|
|
5000
|
+72
|
|
10000
|
+89
|
|
20000
|
+93
|
|
100000
|
+99
|
|
500000
|
+86
|
- 2.5% 灭菌, 冷藏7天。
- 2.5% 室温储存11天。
- 2.5% 室温储存21天。
|
样品
|
时间(天)
|
pH
|
游离硫酸酯 (mg/ml)
|
平均分子量
|
Mw/Mn
|
|
1 (质控品)
|
7
|
6.54
|
0.03
|
42 000
|
1.4
|
|
2
|
11
|
6.25
|
0.03
|
41 400
|
1.4
|
|
3
|
21
|
5.5
|
0.03
|
41 900
|
1.4
|
- 妨碍精确的细胞计数、细胞监测和细胞周围环境的控制。5
- 输送到细胞的营养物质和来自细胞的产物的输送都会受到阻碍。5
- 细胞凝结显著影响生长行为5
- 凝结降低增殖率5
- 与施加在单个细胞的力相比,施加在凝结细胞的垂直方向力导致更高的细胞死亡率。5
- 抗老化
- 抗皱
- 消炎
- 抗过敏
- 保湿
- 光滑、清新和“不油腻”
- 对抗皮肤粗糙和皲裂
- 增加脂肪酶活性,减肥,活肤
|
产品编号
|
品名
|
分子量(kDa)
|
包装
|
|
Dextran sulfate 5 HS
|
5
|
10 g
|
|
|
100 g
|
|||
|
Dextran sulfate 10 HS
|
10
|
10 g
|
|
|
100 g
|
|||
|
Dextran sulfate 20 HS
|
20
|
10 g
|
|
|
100 g
|
|||
|
Dextran sulfate 100 HS
|
100
|
10 g
|
|
|
100 g
|
|||
|
Dextran sulfate 500 HS
|
500
|
10 g
|
|
|
100 g
|
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- LBIS牛血清白蛋白ELSIA试剂盒 LBIS Bovine Albumin ELISA Kit
- 魏则西事件的锅为什么让免疫疗法背?
- 谷氨酸脱氢酶(GLDH/GDH)检测试剂盒用原辅料
- Cell Rep: 胰高血糖素对于糖尿病伴随性心脏病的发生的影响
- 供应体外诊断试剂(IVD,Diagnostic Reagents )研发生产用的生物活性材料:炎症 Inflammation的抗原(Ag)、抗体(Ab)、酶(Enzyme)等
- 人体“基因剪刀”抗癌临床试验首次在美国通过审查
- 生化检测用试剂盒 LabAssay(TM)系列
- 2012年10月慕尼黑生化展
- 艾滋病疫苗又有新靶点
- 合成高分子解决肿瘤耐药问题,搞定耐药癌细胞不是梦!
新进产品
同类文章排行
- 汽巴蓝3G-A(Cibacron Blue 3G-A)
- 异硫氰酸荧光素 (FITC)
- TdB染料
- 透明质酸衍生物 Hyaluronic acid derivatives
- 聚蔗糖 Polysucrose
- 季胺标记葡聚糖 Q-Dextran
- 苯基标记葡聚糖 Phenyl-dextran
- 赖氨酸标记葡聚糖 Lysine-Dextran
- 羧甲基标记聚蔗糖 CM-Polysucrose
- 羧甲基标记葡聚糖 CM-Dextran
资讯文章
您的浏览历史