摘要:研究提示,蛋白斑块中还有上千种随正常衰老会自然沉淀的不溶性蛋白积聚。
人们早就知道,阿尔茨海默病和大多数年龄相关的神经退行性疾病的一个标志是大脑中不溶性蛋白质积聚在一起,尽管每种疾病积聚的典型蛋白质不同。在阿尔茨海默病中,遗传、生化和动物模型数据都支持β淀粉样蛋白 (Aβ),特别是Aβ1-42肽在积聚体形成和神经变性中发挥核心作用。
在正常的无病衰老过程中,也有不溶性蛋白质的积聚。蛋白质稳态的丧失导致不溶性蛋白质积聚,是模式生物衰老过程中一种高度保守的特征,例如在秀丽隐杆线虫中,不溶性蛋白质的积累与衰老密切相关,减缓不溶性蛋白质积累的化合物可以延长寿命。
尽管衰老与阿尔茨海默病风险之间存在明确联系,但迄今为止阿尔茨海默病的研究一直将重点放在一种或两种不溶性蛋白质——tau和β淀粉样蛋白上,偏偏都忽视了衰老引起的多种蛋白质不溶性这一促成因素。
巴克衰老研究所的研究人员最近完成了一项对线虫的系统研究,证实阿尔茨海默病这些不溶性蛋白斑块中还有上千种其他蛋白质——这些蛋白质在正常衰老过程中也会积聚沉淀,被作者称为核心不溶性蛋白质组(CIP)。年老动物提取的这些不溶性蛋白质会加速试管中β淀粉样蛋白沉积,而线虫体内β淀粉样蛋白的表达也会加速这组核心不溶性蛋白质组的不溶性积聚。研究指出这些衰老相关的蛋白质不溶性积聚可能会与阿尔茨海默病中β淀粉样蛋白沉积相互促进,这些蛋白质不溶性有机会成为衰老相关疾病的治疗靶点。研究突显了神经退行性疾病中不溶性蛋白质与衰老之间复杂的相互关系。这项工作还证明了一种干预措施可以通过促进线粒体健康来逆转聚集体的毒性作用。研究结果发表在5月16日《GeroScience》杂志上。
 图1 β淀粉样蛋白加剧与年龄相关的蛋白质组全蛋白质的不溶性
图1 β淀粉样蛋白加剧与年龄相关的蛋白质组全蛋白质的不溶性除了淀粉样蛋白和tau蛋白
迄今为止,大多数关于阿尔茨海默病的研究都集中在蛋白斑块相关的β淀粉样蛋白和tau蛋白。但是一直以来以此为靶标的药物开发并没有达到期望的效果,并引发了对这种靶向的疑问。实际上从AD患者大脑中分离出的不溶性积聚物中除Aβ外,还有数以百计的其他不溶性蛋白质,其同源物可在秀丽隐杆线虫正常衰老形成的蛋白积聚物中找到。这些由衰老引起的不溶性蛋白质组合有可能在AD发病机制中起某种特定作用——有研究表明来自年老动物提取的不溶性蛋白质,在试管中与淀粉样蛋白混合后,会加速β淀粉样蛋白的积聚。
研究小组想知道,阿尔茨海默症的蛋白质积聚斑块和无病正常衰老引起的蛋白质积聚之间有什么联系。Aβ是否会导致这些衰老相关蛋白质的不溶性?在衰老的大脑中,衰老导致的不溶性蛋白质是否可以在破坏性的前馈循环中与Aβ相互作用,从而导致AD中蛋白质不溶性的加速?确定哪些蛋白质以这种方式受到Aβ的影响,将有助于揭示防止Aβ细胞毒性作用的新机制。
他们使用了一种衰老研究的模式生物秀丽隐杆线虫 GMC101,经过改造它在肌肉组织中表达人类促积聚致病性 Aβ 1-42肽,简称为 Aβ。在 20°C 培养发育时,线虫的的 Aβ水平低,但成年初期转移到 25°C后会诱导 Aβ 水平升高。Aβ 诱导 24 小时后,> 80% 麻痹。
研究发现Aβ的表达导致年轻的秀丽隐杆线虫成年动物中整个蛋白质组范围内多种不溶性蛋白质总量的显著增加,影响广泛的基本功能,这些因Aβ表达引起的不溶性蛋白质组合与正常衰老导致的不溶性蛋白质组合高度相似。“我们发现β淀粉样蛋白会导致大量的蛋白不溶解性,即使在非常年轻的动物身上也是如此。”作者将这一组蛋白质组合称为核心不溶性蛋白质组(CIP)。作者发现核心不溶性蛋白质组(CIP)中包含有许多能修饰 Aβ 毒性的蛋白质,这提示 AD 背景下可能存在恶性前馈循环(不溶性沉积使得能修饰Aβ毒性的蛋白质减少,提高Aβ毒性,促进不溶性沉积)。利用人类全基因组关联研究 (GWAS),研究证实核心不溶性蛋白质组中包含了许多与各种神经退行性疾病有关、与许多慢性病、年龄相关疾病 (CARD)有关的蛋白质。这提示了与年龄相关的蛋白质稳态丧失可能在一般CARD风险中发挥作用。
Aβ会导致这些在正常衰老中慢慢积聚的蛋白质加快沉积。淀粉样蛋白和衰老可能以类似的方式影响这一组蛋白质。“这很可能是一个恶性循环,衰老导致蛋白不溶性,淀粉样蛋白也导致蛋白不溶性,它们只会使彼此变得更糟糕。“
研究还证明了降低不溶性蛋白质组中特定蛋白的表达可以促进或延缓线虫Aβ毒性。具有老年保护作用的肠道代谢物尿石素A (Urolithin A)可以减轻Aβ的毒性,支持其用于痴呆和年龄相关疾病的临床试验。研究CARD机制的临床医师和科学家在研究衰老和所关注的疾病之间的相互作用时,可以考虑蛋白质不溶解性的作用。靶向不溶性蛋白质组可为不同年龄相关疾病的预防和治疗提供新的策略。
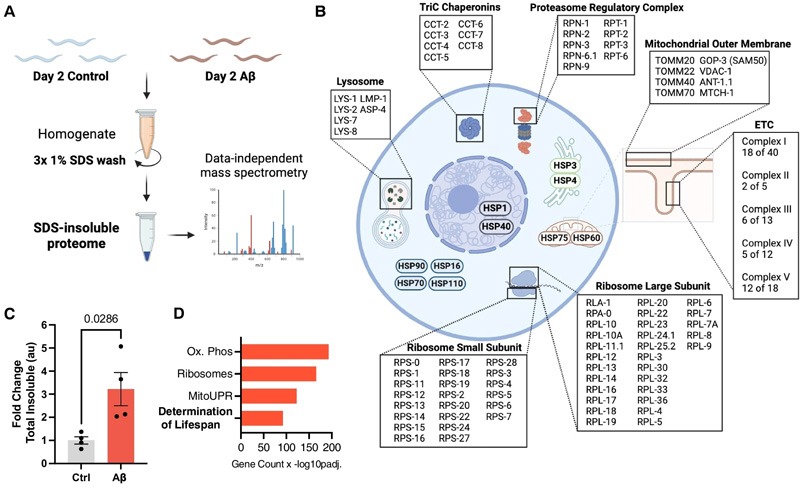 图2 β淀粉样蛋白驱动蛋白质组全蛋白质的不溶性,类似于正常衰老
图2 β淀粉样蛋白驱动蛋白质组全蛋白质的不溶性,类似于正常衰老作者视角
不溶性蛋白质促进正常衰老与疾病,也为衰老和与年龄相关的疾病是如何发生提供了一个研究方向。巴克研究院教授Gordon Lithgow博士说:“我们认为,这项工作确实支持了老年科学的一种假设,即阿尔茨海默病和衰老本身存在共同的途径。”“衰老是导致这种疾病的因素,但实际上,让你走上这种疾病的道路的因素很早就发生了。”研究小组发现了一组核心的不溶性蛋白质组,其中包含许多以前没有考虑过的蛋白质,这一事实为探索创造了新的目标。“从某种程度上说,这表明我们是否应该考虑老年痴呆症在非常年轻的人群中是什么样子。”
Edward Anderton博士表示,“根据我们的发现,靶向不溶性蛋白质可以为预防和治疗各种与年龄相关的疾病提供一种策略,”他是Gordon Lithgow实验室的博士后,也是发表在5月16日《GeroScience》杂志上的一项研究的第一作者之一。
保护线粒体 延缓淀粉样蛋白毒性
淀粉样蛋白对线虫有很大的毒性,研究小组想找到一种方法来逆转这种毒性。由于数百种线粒体蛋白质在衰老和表达淀粉样蛋白后变得不溶,作者认为,如果可以使用一种化合物来提高线粒体蛋白质的质量,那么也许可以扭转淀粉样蛋白的一些负面影响。尿石素A(Urolithin A)是我们吃覆盆子、核桃和石榴时产生的一种天然肠道代谢物,已知可以改善线粒体功能,作者发现使用尿石素A能显著延缓了淀粉样蛋白的毒性作用。
该研究的第一作者之一 Manish Chamoli博士说“我们的研究表明,保持健康的线粒体可以对抗与衰老和阿尔茨海默氏症相关的蛋白质聚集,”“通过促进线粒体健康,我们有可能减缓或逆转这些有害影响,为治疗衰老和与年龄相关的疾病提供新的方法。”
Anderton说:“从我们的数据中可以明显看出,线粒体的重要性不断上升。”结论是提醒我们,线粒体的健康对整体健康至关重要。“线粒体与衰老有着密切的联系。它们与淀粉样蛋白有很强的联系,”“我认为我们的研究是少数几个表明这些蛋白质的不溶解性和聚集性可能是两者之间联系的研究之一。”
“因为线粒体对所有这些都是如此重要,打破衰退的恶性循环的一种方法是用新的线粒体代替受损的线粒体,”Lithgow说。“你是怎么做到的?”你锻炼身体,保持健康饮食。”
参考资料
[1] Amyloid β accelerates age-related proteome-wide protein insolubility