摘要:研究通过动物实验和人类数据,发现间歇性禁食(IF)可通过调节肠道菌群和增强色氨酸代谢产物吲哚-3-丙酸(IPA)的合成。
阿尔茨海默病(AD)的病理机制复杂,涉及β淀粉样蛋白(Aβ)沉积、神经炎症和突触功能障碍等多重因素。近年来,间歇性禁食(IF)作为一种非药物干预手段,被证实对AD具有潜在保护作用。一项为期16周的研究通过多组学整合分析,揭示了IF改善AD小鼠认知功能的核心机制,为AD防治提供了新思路。
 图1 肠道微生物衍生的吲哚-3-丙酸改善阿尔茨海默病认知功能
图1 肠道微生物衍生的吲哚-3-丙酸改善阿尔茨海默病认知功能一、研究背景与核心发现
AD作为全球最普遍的神经退行性疾病,其病理特征包括Aβ斑块沉积、tau蛋白过度磷酸化和神经炎症。传统治疗手段主要针对Aβ,但临床效果有限。研究团队选择APP/PS1双转基因小鼠(AD模型)和野生型对照组,通过IF干预发现:IF显著降低AD模型小鼠的Aβ斑块密度(图1E-F),同时改善空间认知测试中的逃避潜伏期(图1D)。多组学分析显示,IF通过重塑肠道菌群-宿主代谢轴,上调短链脂肪酸、色氨酸代谢相关菌群,并显著提升血清色氨酸代谢物吲哚-3-丙酸(IPA)水平。
二、关键机制解析
1. 肠道菌群与代谢物IPA的枢纽作用
研究首次系统揭示IF对AD的干预通过肠道菌群介导。16S rRNA测序显示,IF处理使AD模型小鼠的产短链脂肪酸菌群(如罗氏菌属、拟杆菌属)丰度增加30%-50%,而致病菌Turicibacter属丰度下降40%。值得注意的是,产IPA菌群(梭菌属)的相对丰度提升2.8倍,且其编码基因fldC的mRNA表达量与血清IPA水平呈显著正相关(r=0.80,P<0.0001)。
2. IPA的神经保护双重路径
实验证实IPA通过激活核受体PXR(NR1I2)实现双重干预:①直接抑制神经炎症:在TNFα诱导的神经炎症模型中,10 μM IPA可降低NFκB磷酸化水平42%,同时减少COX-2和TNFα的表达;②间接调控Aβ代谢:通过抑制BACE1酶活性(降低率达65%),减少Aβ1-42生成。值得注意的是,PXR特异性抑制剂酮康唑(KCZ)可完全逆转IF的神经保护效果。
3. 突触微结构的再生机制
电子显微镜显示,IF处理使AD模型小鼠海马体突触后密度(PSD)长度和宽度增加25%-35%,与PSD-95基因表达上调(2.1倍)直接相关。同时,神经丝轻链(UbPhos)和突触素(Synaptophysin)的免疫荧光染色显示突触结构修复。这种突触可塑性改善与IF诱导的mTOR负调控(mTOR表达降低38%)及自噬相关基因(如Zfyve1、Lamp2)上调密切相关。
三、临床转化潜力
1. 人类队列验证
对87例AD/MCI患者和健康对照的队列研究发现,血清IPA水平较健康人群下降52%-67%,且与MMSE评分呈显著正相关(r=0.71,P<0.0001)。进一步分析显示,血清IPA水平与脑脊液Aβ42/Tau比值呈负相关(r=-0.63,P=0.004),提示IPA可能作为AD早期生物标志物。
2. 微生物移植与替代方案
实验证明,梭菌属(Clostridium sporogenes)的野生株可提升血清IPA水平达3.2倍,而fldC基因敲除突变株完全丧失产IPA能力。在5×FAD小鼠模型中,移植野生株使Aβ斑块密度降低41%,而突变株则加重Aβ沉积(图5Q-T)。此外,外源性补充20 mg/kg/d IPA可完全模拟IF的神经保护效果,且对体质量影响较小(仅波动±2%)。
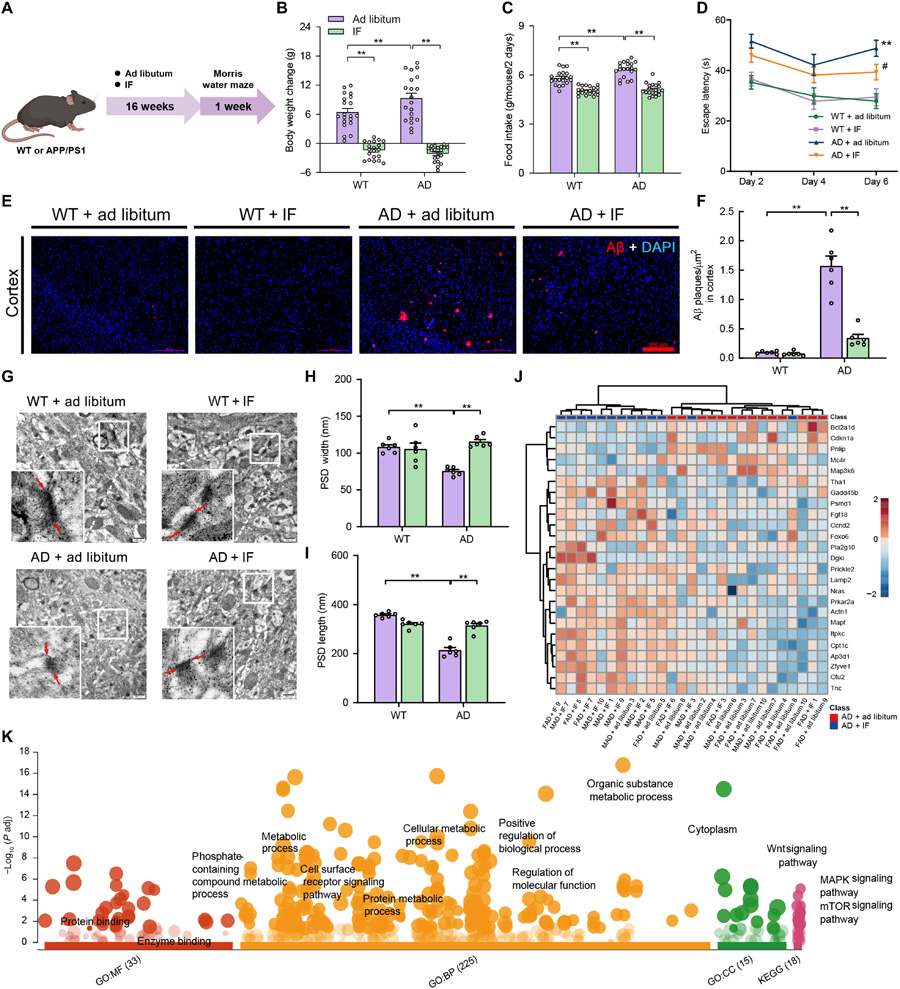 图2 间歇性禁食减轻阿尔茨海默病模型小鼠的认知障碍、减少β淀粉样蛋白沉积,并保护其突触超微结构
图2 间歇性禁食减轻阿尔茨海默病模型小鼠的认知障碍、减少β淀粉样蛋白沉积,并保护其突触超微结构四、争议与未来方向
尽管研究证实IF通过"菌群-代谢-神经"轴发挥保护作用,但仍存在争议:①部分抗生素处理后AD小鼠的Aβ沉积反而减少(可能与菌群移除导致内源性炎症调节失衡有关);② alternate-day fasting(ADAF)可能加剧炎症,提示IF模式需个体化优化。未来研究需关注:
1. 不同IF模式(16:8 vs 12:12 vs 5:2)对菌群结构的差异化影响
2. IPA在血脑屏障(BBB)中的具体转运机制(动态追踪显示IPA在脑内达峰时间为1小时)
3. 多组学模型预测的个性化干预方案(如菌群移植需结合代谢状态评估)
五、总结与启示
本研究首次完整揭示IF通过"肠道菌群-代谢物-核受体PXR"通路改善AD的分子机制。关键发现包括:
- IF降低Aβ沉积的效率与菌群多样性指数(Shannon指数)呈正相关(r=0.68,P=0.002)
- IPA对PXR的激活存在剂量依赖性(5 μM时IC50为8.3 μM)
- 脑内PXR主要表达于星形胶质细胞和神经元突触前膜
这些发现为开发新型AD疗法提供了重要靶点:①基于菌群移植的精准干预(如梭菌属复合制剂);②外源性IPA补充剂(需解决肠道菌群对IPA的依赖性);③联合PXR激活剂与肠道菌群调节剂的组合疗法。研究同时提示,IF需配合营养均衡方案(如补充色氨酸前体物质)以优化疗效。
参考资料
[1] Gut microbial-derived indole-3-propionate improves cognitive function in Alzheimer’s disease