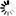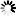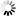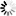第一个遗传性阿尔茨海默病狨猴动物模型
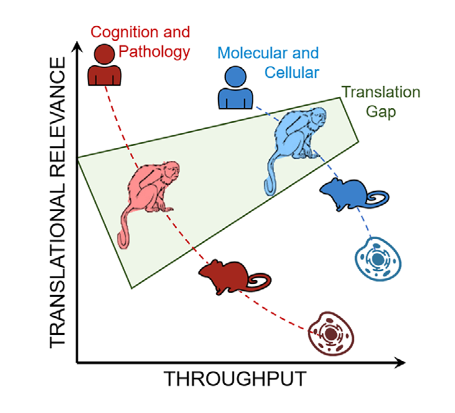
图1 狨猴模型弥补了目前人类研究与AD细胞和啮齿动物模型之间的翻译差距
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
相关资讯
- 内毒素检测知多少(上篇)
- Science:重磅!科学家成功实现对猕猴机体SIV病毒的持续控制
- Cell Rep:揭示T细胞中PD-1信号传输的通路
- 小心了!Cell揭示缺少这种淋巴细胞可保护癌细胞、抵抗肿瘤治疗!
- 新验血法评估衰老程度 或可预测老年痴呆
- PNAS惊人大发现!发烧竟能抗癌,“小病不断,大病不犯”或许不是谣传
- 下一个紫杉醇?日本新研究揭示沙姜抗癌治腹水的主要活性成分EMC的抗癌特性
- 定量检测血清和血浆中抗-PEG IgM的ELISA试剂盒
- 西宝生物第二次参加Supplyside West
- 互联网医疗将迎来爆发元年:2020
新进产品
同类文章排行
- 第一个遗传性阿尔茨海默病狨猴动物模型
- 突破!可杀死耐药菌的新型抗生素
- Nature:利用CRISPR,终于弄清楚了一种独特的免疫细胞是如何识别并摧毁肿瘤的
- 下一个紫杉醇?日本新研究揭示沙姜抗癌治腹水的主要活性成分EMC的抗癌特性
- Cell:染色质重塑是DNA甲基化的表观遗传基础
- NAR:新的基因编辑技术为精确治疗提供了途径
- 葡萄糖致癌的直接作用靶点
- 最后一块拼图,人类Y染色体的完整序列首次公布
- 靶向突变KRAS活性状态的细胞伴侣的化学重塑
- Science:“食油”微生物重塑油滴,加速碳氢化合物的生物降解
资讯文章
您的浏览历史