-
- 麻省理工学院的神经科学家发现了一种方法,可以通过干扰阿尔茨海默病患者大脑中通常过度活跃的一种酶来逆转神经退行性变和阿尔茨海默病的其他症状。当研究人员用一种肽来阻止一种叫做CDK5的酶的过度活跃版本时,他们发现大脑中的神经退行性疾病和DNA损伤显著减少。这些小鼠还表现出执行任务的能力有所提高,比如学习在水迷宫中穿行。[查看]
- http://cxbio.com/Article/mitdiscovery_1.html
-
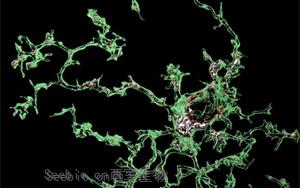
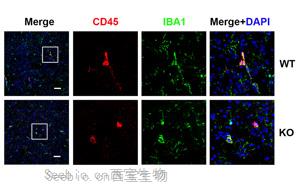
- 小胶质细胞是保护哺乳动物大脑的初级免疫细胞,部分是通过吞噬病原体和有毒碎片来实现的。最近的遗传学研究一直强调小胶质细胞在阿尔茨海默病(AD)和其他神经退行性疾病发展中的作用,表明它们可以异常地开始吞噬突触,神经元之间的关键连接。现在,伦敦大学学院(UCL)英国痴呆症研究所的研究人员进行了一项研究,旨在更好地了解小胶质细胞可以增加患AD风险的吞噬过程。[查看]
- http://cxbio.com/Article/naturezkxgzwxbyfaech_1.html
-
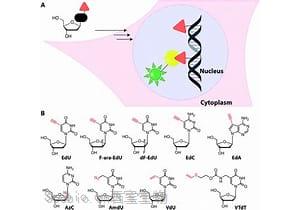
- 根据3月7日发表在公开期刊上的一项新研究,减少关键信使RNA的甲基化可以促进巨噬细胞向大脑的迁移,并改善小鼠模型中阿尔茨海默病的症状。[查看]
- http://cxbio.com/Article/xgmrnahkzlaechmb_1.html
-
- 来自西奈山的科学家们对DNA甲基化在阿尔茨海默病(AD)中的作用提供了新的见解。根据他们的研究,DNA甲基化对AD相关基因和蛋白质的共表达网络有显著影响。因此,这可能会揭示新的神经病理过程和分子机制,最终导致阿尔茨海默病的创新治疗干预措施的发展。[查看]
- http://cxbio.com/Article/aezhmybgyczjdlxgysjb_1.html
-
- 草甘膦是许多商业除草剂中的活性成分,是全球应用最广泛的除草剂。在小麦、水稻、玉米和大豆等作物中使用草甘膦的增加与阿尔茨海默病(Alzheimer’s disease,AD)和其他神经退行性疾病导致的死亡率增加呈正相关。此外,草甘膦暴露会增加血浆中的促炎细胞因子,尤其是TNFα(Tumor necrosis factor α)。草甘膦已被证明可以穿过血脑屏障,但尚未在体内得到验证。[查看]
- http://cxbio.com/Article/wlktzszdnyclkyfaechm_1.html
-
- 阿尔茨海默病(AD)是一种复杂的神经退行性疾病。多年来,阿尔茨海默病的研究主要专注于少数病理改变,比如大脑中tau蛋白和β-淀粉样蛋白的异常积累。近期的一项综合调查表明,过去30年的研究主要集中于某些生物学通路(特别是免疫和代谢通路),但还有数百条通路与这种疾病有关。[查看]
- http://cxbio.com/Article/dcxsaechmbyjzzmsfx_1.html
-

- 今日,BioBAY园内企业新旭(APRINOIA Therapeutics)宣布完成了总额达4000万美元的C轮融资。新旭此次所募集的资金主要用于推进阿尔茨海默病tau蛋白正电子发射断层扫描(PET)示踪剂在国内的临床三期试验与其商业化,以及继续开发适用于神经退行性疾病的药物。此外,公司将持续扩大其药物发现与开发平台及管线,并携手国内外合作伙伴打造领先并具国际水平的脑部PET临床影像联盟。[查看]
- http://cxbio.com/Article/xxwcclrztjsjtxxjbzdj_1.html
-
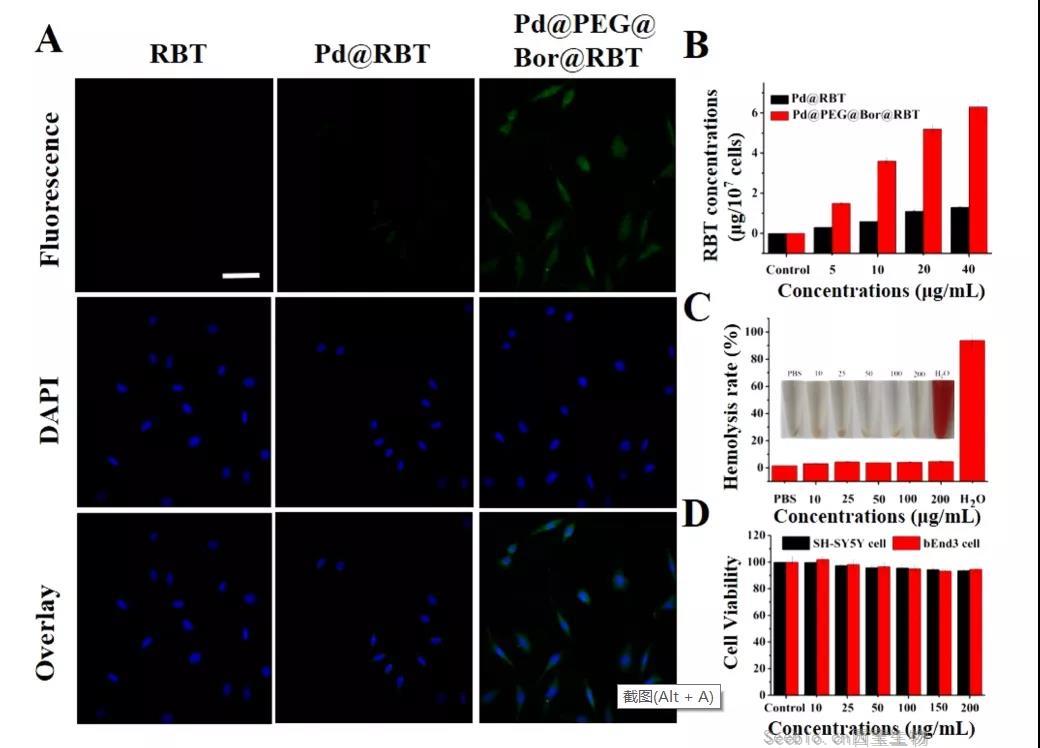
- 阿尔茨海默病(AD)俗称老年痴呆症,是一种神经退行性疾病,是一种与淀粉样蛋白原纤维(Aβ)沉积和神经纤维缠结(NFTs)密切相关的线粒体功能障碍。治疗AD的药物一直在开发,但是效果都很有限,主要原因是:对认知功能的影响较差或有显著的副作用以及血脑屏障穿透性较弱,难以达到理想的治疗效果。[查看]
- http://cxbio.com/Article/gkaechmzdsgnmmfhclhk_1.html
-

- 近日,宾夕法尼亚大学的科研人员在《PLOS Biology》杂志发表了一篇文章,研究分享了睡眠依赖性低频 (<0.1 Hz) 全脑活动在清除阿尔茨海默病相关毒素积聚方面的有力证据。[查看]
- http://cxbio.com/Article/xyjjsayzdhbssmqjdnhq_1.html
-
- 神经炎症与阿尔茨海默病(Alzheimer’s disease, AD)密切相关。越来越多的人已认识到神经炎症在AD起着关键作用。环氧脂肪酸(epoxy fatty acid, EpFA)是花生四烯酸代谢途径的衍生物,具有抗炎活性。然而,由于EpFA被可溶性环氧水解酶(soluble epoxide hydrolase, sEH)快速水解,它们的功效受到限制。在一项新的研究中,来自美国贝勒医学院的研究人员报道sEH主要在星形胶质细胞中表达,并在AD患者的死后大脑组织和5xFAD β淀粉样蛋白AD小鼠模型中升高。这种AD小鼠模型大脑中表达的sEH数量与大脑EpFA浓度下降有关。[查看]
- http://cxbio.com/Article/sciencezkhysjmyzjkjd_1.html
-

- β-淀粉样蛋白(Aβ)是阿尔茨海默病主要病理特征——老人斑的主要构成成分,是通过β分泌酶和γ分泌酶切断β-淀粉样蛋白前体蛋白质(APP)而产生的。因此,分泌酶抑制剂可作为β-淀粉样蛋白产生抑制剂进行研究。[查看]
- http://cxbio.com/Article/aezhmzyjyfmmyzj_1.html
-

- 作为FUJIFILM-Wako官方授权的科研试剂综合供应商,西宝生物不仅可以提供Wako的β-淀粉样蛋白(Amyloid beta-Protein)相关试剂,而且提供磷酸化Tau蛋白/总Tau蛋白检测ELISA试剂盒以及相关研究抗体,应用于阿尔茨海默病的研究中,轻松检测磷酸化Tau蛋白(T181)和总Tau蛋白。[查看]
- http://cxbio.com/Article/taudb_1.html
-

- 近年来,β-淀粉样蛋白(Aβ)寡聚体作为阿尔茨海默病因而倍受瞩目。Aβ寡聚体中,按照分子量的大小,可以分成低分子量的Aβ寡聚体和高分子的Aβ寡聚体。有相关的报告指出,高分子Aβ寡聚体的Aβ*56(12-mer)对记忆损伤的影响极大。Wako推出了高分子β-淀粉样蛋白寡聚体ELISA试剂盒用于阿尔兹海默症研究用,性能优越,咨询订购请拨打:400-021-8158[查看]
- http://cxbio.com/Article/aechmbyjygfzdfydbgjt_1.html
-

- β-淀粉样蛋白(Aβ;)是由约40个氨基酸组成的多肽,在阿尔茨海默病患者的大脑内大量积蓄,形成老年斑,Aβ;被认为是引发阿尔茨海默病的病因之一。Aβ;主要的亚型包括Aβ;40(40个氨基酸)、Aβ;42(42个氨基酸)以及Aβ;43(43个氨基酸)。Wako推出了识别不同表位的4个克隆号(BAN 50/BNT 77/BA 27/BC05)的单克隆抗体用于阿尔兹海默症研究用,经多种实验相关验证(IHC、WB、ELISA)性能优越[查看]
- http://cxbio.com/Article/aechmbyjykdfydbktban_1.html
-
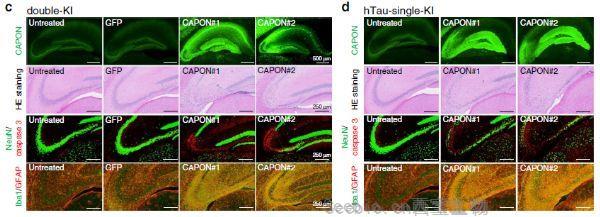
- 一种与阿尔茨海默病(AD)有关的新蛋白质已被日本理化研究所脑科学中心(RIKEN CBS)的研究人员发现。CAPON可能促进两个最著名的AD罪魁祸首--淀粉样斑块和tau病理之间的联系,二者的相互作用会导致脑细胞死亡和痴呆症状。这一最新发现来自RIKEN CBS的Takaomi Saido小组,他们使用了一种新颖的小鼠AD模型,这项研究发表在《自然通讯》杂志上。[查看]
- http://cxbio.com/Article/natcommunaezhmzbldby_1.html
相关搜索
西宝生物资讯
-
 西宝生物企业营业执照
西宝生物企业营业执照 -
 西宝生物对外贸易经营者备案登记表
西宝生物对外贸易经营者备案登记表 -
 西宝生物 laysan - 代理证书
西宝生物 laysan - 代理证书 -
 西宝生物 Ludger - 代理证书
西宝生物 Ludger - 代理证书 -
 西宝生物 Reagecon - 代理证书
西宝生物 Reagecon - 代理证书 -
 西宝生物 富士 - 和光纯药 代理证书
西宝生物 富士 - 和光纯药 代理证书 -
 西宝生物 Fortis - 代理证书
西宝生物 Fortis - 代理证书 -
 西宝生物 环凯 - 代理证书
西宝生物 环凯 - 代理证书 -
 西宝生物企业系统建设优秀单位
西宝生物企业系统建设优秀单位 -
 西宝生物 中国制造网认证供应商
西宝生物 中国制造网认证供应商 -
 西宝生物 Lumiprobe代理证书
西宝生物 Lumiprobe代理证书 -
 西宝生物 Elicityl - 代理证书
西宝生物 Elicityl - 代理证书 -
 西宝生物 LKT - 代理证书
西宝生物 LKT - 代理证书 -
 西宝生物 2A - 代理证书
西宝生物 2A - 代理证书 -
 西宝生物 高新技术企业证书
西宝生物 高新技术企业证书 -
 西宝生物 BioVendor - 代理证书
西宝生物 BioVendor - 代理证书 -
 西宝生物 Bioporto - 代理证书
西宝生物 Bioporto - 代理证书 -
 西宝生物 BioAssay - 代理证书
西宝生物 BioAssay - 代理证书 -
 西宝生物 Jackson Immuno Research - 代理证书
西宝生物 Jackson Immuno Research - 代理证书 -
 西宝生物 Creative PEGWorks - 代理证书
西宝生物 Creative PEGWorks - 代理证书







