金属螯合介质(IDA)——层析介质优选西宝生物
金属螯合亲和层析,又称固定化金属离子亲和层析(Immobilized metal ion affinity chromatography, IMAC)。该法利用蛋白质表面的某些氨基酸(如组氨酸、色氨酸、半胱氨酸等)和金属离子(Cu2+、Zn2+、Ni2+等过渡金属离子)发生特殊的相互作用的原理,从而实现蛋白质的分离。
表1. Ni-IDA QZT 6FF的理化性质及特征参数
|
参数
|
指标
|
|
基质
|
6%交联琼脂糖凝胶
|
|
配基
|
-N(CH2COOH)2 (IDA)
|
|
形状
|
球形
|
|
平均粒径
|
90 μm (45-165)
|
|
金属离子密度
|
~40 μmol Ni2+/mL wet gel |
|
动态载量a
|
~25-30 mg His-Tagged LDH/mL wet gel
|
|
推荐流速b
|
5-10 mL/min (150-300 cm/h)
|
|
流速高达b
|
20 mL/min (600 cm/h)
|
|
耐压高达b
|
0.3 MPa (3 bar)
|
|
化学稳定性c
|
0.01 M HCl、0.1 M NaOH(37 °C, 7天);1 M NaOH、70%乙酸(12 h);30%异丙醇(30 min);2% SDS(1 h) |
|
避免使用的试剂
|
螯合剂,如EDTA、EGTA、柠檬酸等
|
|
pH稳定性c
|
2-14(短期,2 h);3-12(长期,7天)
|
|
储存条件
|
20%乙醇,4-30 ℃
|
样品:平衡缓冲液中含1mg/mL histidine-tagged LDH(Mr 140000);
b:流动相为纯水,室温下操作,柱尺寸为10.0*1.6 cm I.D.,CV=20.0 mL。
|
试剂类型
|
试剂名称及浓度
|
|
还原试剂
|
10 mM β-巯基乙醇
|
|
变性剂
|
8 M 尿素、6 M 盐酸胍
|
|
去污剂
|
2%Triton X-100、2%Tween-20、2%NP-40、2%胆酸盐、1%CHAPS
|
|
缓冲液组分
|
50 mM 磷酸钠, pH7.4、100 mM Tris-HCl,pH7.4、100 mM Tris-acetate, pH7.4、100 mM HEPES,pH7.4、100 mM MOPS,pH7.4、100 mM 醋酸钠,pH7.4 |
|
其它试剂
|
20%乙醇、50%甘油、0.1 M Na2SO4、1.5 M NaCl、1 mM EDTA、60 mM 醋酸 |
金属螯合层析可采用重力柱、蠕动泵和层析系统等模式进行操作。以层析系统操作模式为例,层析操作通常包括装柱、螯合金属离子、平衡、进料、淋洗、洗脱、再生等步骤(具体操作条件以10.0 * 1.6 cm I.D.,CV=20.0 mL层析柱为例)。
1. 装柱:
(1)Ni-IDA QZT 6FF介质通常在4 ℃下保存于20%乙醇中,使用前先取出适量(22 mL介质)介质放置于烧杯中,用纯水置换掉20%的乙醇溶液,静置沉降后倒掉部分上清至凝胶浓度约为60%(匀浆液体积约为36 mL),搅拌均匀后备用(匀浆液温度尽量接近室温)。
(2)清洗层析柱及配件,排气泡后拧紧层析柱底端的出口,加入适量纯水至0.2-0.5 cm液位高度。
(3)用玻璃棒将介质匀浆液轻轻搅拌均匀(避免引入气泡),然后用玻璃棒导流将匀浆液沿着柱内壁一次性倒入柱内,尽量避免产生气泡。介质在层析柱内自由沉降后(30 min),连结好柱子顶端柱头(预先去除管道内及接口处的气泡)。
(4)打开泵,先用纯水以2.5 mL/min的流速压柱(10 min至胶面),然后再以4mL/min的流速压柱,使柱床稳定,调节顶端柱头至胶面处。用2~3倍柱体积(CV)的缓冲液平衡柱子。
|
层析柱
|
装柱流速(mL/min)
|
使用流速高值(mL/min)
|
|
|
第一步
|
第二步
|
||
|
20 mm×10 mm I.D.
|
0.9
|
4.7
|
2
|
|
20 mm×16mm I.D.
|
2.5
|
8.7
|
5
|
|
20 mm×26 mm I.D.
|
6.6
|
23
|
13
|
|
20 mm×50 mm I.D.
|
24.5
|
85
|
49
|
(2)选择合适的金属离子(Cu2+、Zn2+、Ni2+、Co2+、Fe3+等),溶解在中性或弱酸性溶液中,浓度为用0.2 mol/L,过滤后使用,其中Fe3+必须在低pH(3.0)下鳌合,以防止Fe3+产生沉淀;
3. 平衡:用5-10 CV的平衡缓冲液平衡层析柱,至流出液电导和pH保持不变(与平衡液一致)。实际操作中,一般选用中性/弱碱性(pH 7-8)的高盐(0.15-1.0 M NaCl或其它中性盐)缓冲液。其中常用磷酸盐缓冲体系,如20 mM PB+0.5 M NaCl, pH 7.4。对于结合力较强的带组氨酸标记的蛋白质,平衡缓冲液中可加入低浓度(5-50 mM)的咪唑(具体浓度需要根据实验现象进行优化)。
4. 进料:样品缓冲液应尽可能与平衡液一致。固体样品可用平衡液溶解配制;低浓度样品溶液可用平衡液透析;高浓度样品溶液可用平衡液稀释。为了避免堵塞层析柱,样品应经离心或微滤处理。为了减少杂蛋白在层析柱上的吸附,可在确保目标蛋白吸附的情况下适当增加样品缓冲液中的咪唑(具体浓度根据优化结果确定,并与平衡缓冲液的咪唑浓度保持一致)。
5. 淋洗:上样完毕后继续用平衡缓冲液淋洗至基线。
6. 洗脱:一般采用竞争试剂咪唑进行洗脱,并在洗脱缓冲液中加入一定浓度(0.15-1.0 M)的NaCl以抑制离子交换作用。洗脱缓冲液一般为20 mM PB + 0.5 M NaCl + 0.5 M咪唑,pH 7.4。可采用线性梯度或阶越式梯度洗脱(洗脱时所需的咪唑浓度与所纯化蛋白的结合强度有关,可通过洗脱浓度优化得到)。对于包涵体蛋白,相应地可在平衡、上样和洗脱的缓冲液中加入8 M Urea或6 M Gua-HCl。洗脱后再对变性蛋白进行复性。
7. 再生:介质使用数次(约3-20次,具体与原料来源、样品体积等有关)后,或者螯合其它金属离子前,需要进行再生处理。首先用2-3 CV的纯水清洗层析柱,然后用5 CV的20 mM PB + 0.5 M NaCl +50 mM EDTA,pH 7.4淋洗柱子,再分别用5 CV的20 mM PB + 0.5 M NaCl,pH 7.40溶液和5 CV的纯水清洗柱子,去除柱上残留的EDTA。螯合金属离子的操作按照“3.2”所述进行。若有变性蛋白质或脂类物质在再生过程中未能有效去除,可用在位清洗(cleaning in place, CIP)的方法去除。
8. 原位清洗:为了避免不同样品间的相互干扰,或者当介质污染比较严重时(反压增加),需要对介质进行在位清洗。在位清洗前,需要预先去除介质上鳌合的金属离子。在位清洗时,可采用反向冲洗的方法。
(3)对疏水性结合的蛋白、脂蛋白和脂类物质,可用5-10 CV的70%乙醇或30%异丙醇清洗(15-20 min),并用5-10 CV的纯水冲洗。
9. 其它注意事项:在使用和保存柱子的时候,要避免柱子流干,气泡进入。
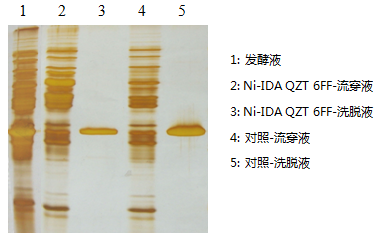
Ni-IDA QZT 6FF纯化His-tag LDH。
层析介质:Ni-IDA QZT 6FF介质(10.0 cm × 1.6 cm I.D., CV=20 mL);
样品:His-tag LDH发酵液;
平衡缓冲液:20 mM PB + 0.15 M NaCl + 50 mM 咪唑, pH 7.4;
洗脱缓冲液:20 mM PB + 0.15 M NaCl + 0.5 M 咪唑, pH 7.4;
流速:5 mL/min;
进料量:60 mL。
 |
 |
 |
| 官网:www.cxbio.com | 微信服务号:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信订阅号:seebiotech | 泉养堂:www.canmedo.com |
新进产品
同类文章排行
- 蛋白质检测BCA试剂盒
- 蛋白质检测Bradford试剂
- 抗微管蛋白(甘氨酰化),多克隆抗体(Gly-pep1)
- 重组赖氨酰内肽酶RLys-C
- 重组双碱性氨基酸内肽酶(RKex2)
- 重组羧肽酶B(RCPB)
- 护关节,从源头做起,西宝生物的高效原料解决方案
- 重组胰蛋白酶(RTrypsin)
- 测序级重组赖氨酰内肽酶/胰蛋白酶预混装
- 胰蛋白酶,猪胰腺来源,质谱等级
资讯文章
您的浏览历史